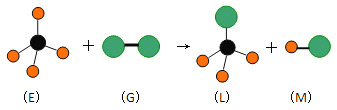
题目内容
【题目】我国科学家通过测量SiO2中的26Al和10Be两种元素的比例确定“北京人”年龄,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)写出Be的核外电子排布式_______________。Be所在的周期中,最外层有2个未成对电子的元素的符号是_______、_________。
(2)写出Al的最外层电子轨道表示式__________________。铝原子核外有_______种运动状态不同的电子;铝原子核外有_______中能量不同的电子。
(3)比较Al3+、S2-和Cl-半径由大到小的顺序_________________________;这3种元素最高价氧化物对应的水化物中酸性最强的是___________(写化学式)。
(4)铝元素最高价氧化物与氢氧化钠溶液反应的化学方程式______________________________。
【答案】1s22s2 C O ![]() 13 5 S2->Cl->Al3+ HClO4 Al2O3+2NaOH→2NaAlO2+H2O
13 5 S2->Cl->Al3+ HClO4 Al2O3+2NaOH→2NaAlO2+H2O
【解析】
(1)Be的原子序数为4,位于第二周期第ⅡA,写出核外电子排布式,与Be所在的周期中,最外层有2个未成对电子的元素是C:1s22s22p2,O:1s22s22p4;
(2)Al的最外层有3个电子,电子排布式为1s22s22p6s23p1;铝原子核外有13种运动状态不同的电子;铝原子核外电子排布为1s22s22p63s23p1,五种轨道,五种能量。
(3)比较微粒半径①电子层越多,半径越大②当电子层数相同时,核电荷数越大,吸电子能力越强,半径越小;元素非金属性越强,最高价氧化物水化物酸性越强。
(4)铝元素最高价氧化物为Al2O3可以与氢氧化钠反应生成偏铝酸钠与水。
(1)Be的原子序数为4,位于第二周期第ⅡA,核外电子排布式为1s22s2,与Be所在的周期中元素C:1s22s22p2,O:1s22s22p4,2p轨道均有2个未成对电子;
答案:1s22s2 C O
(2)Al的最外层有3个电子,电子排布式为3s23p1,则最外层电子轨道表示式为![]() ;铝原子核外有13个电子则有13种运动状态不同的电子;铝原子核外电子排布为1s22s22p63s23p1,五种轨道,五种能量;
;铝原子核外有13个电子则有13种运动状态不同的电子;铝原子核外电子排布为1s22s22p63s23p1,五种轨道,五种能量;
答案:13 5
(3)比较半径①电子层越多,半径越大②当电子层数相同时,核电荷数越大,吸电子能力越强,半径越小,因此离子半径 S2->Cl->Al3+;元素非金属性越强,最高价氧化物水化物酸性越强,氯元素的非金属性最强,则 HClO4酸性最强。
答案: HClO4
(4)铝元素最高价氧化物为Al2O3可以与氢氧化钠反应生成偏铝酸钠与水,方程式为 Al2O3+2NaOH→2NaAlO2+H2O;
答案: Al2O3+2NaOH→2NaAlO2+H2O

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】党的十九大报告中多次提及“绿色环保”“生态文明”,而CO2的有效利用可以缓解温室效应,解决能源短缺问题。中科院大连化学物理研究所的科研人员在新型纳米催化剂Na—Fe3O4和HMCM—22的表面将CO2转化为烷烃,其过程如图。

上图中CO2转化为CO的反应为:CO2(g)+H2(g)=CO(g)+H2O(g) △H =+41kJ/mol
已知:2CO2(g)+6H2(g)= C2H4(g)+ 4H2O(g) △H =-128kJ/mol
(1)图中CO转化为C2H4的热化学方程式是______________________。
(2)Fe3O4是水煤气变换反应的常用催化剂,可经CO、H2还原Fe2O3制得。两次实验结果如表所示:
实验I | 实验II | |
通入气体 | CO、H2 | CO、H2、H2O(g) |
固体产物 | Fe3O4、Fe | Fe3O4 |
结合化学方程式解释H2O(g)的作用______________________。
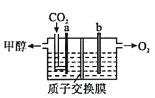
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如图所示,电极a接电源的____________极(填“正”或“负”),生成甲醇的电极反应式是______________________。
(4)用CO、H2生成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
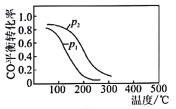
①△H2______________(填“>”“<”“=”)0。
②写出两条可同时提高反应速率和CO转化率的措施______________________________________。
③下列说法正确的是___________(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充人稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④0~3min内用CH3OH表示的反应速率v(CH3OH)=____________mol·L-1·min-1
⑤200℃时,该反应的平衡常数K=_____________。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变则化学平衡__________(填“正向”“逆向”或“不”)移动。