题目内容
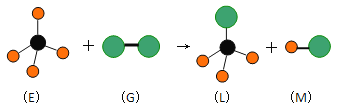
【题目】短周期元素W、X、Y、Z的原子序数依次增大。其中X与Y可形成一种淡黄色物质P,常温下将0.05mol P溶于水,配成1L溶液,其中![]() ;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是( )
;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是( )
A.简单离子半径:X>Y>Z
B.氢化物的沸点:W<X
C.化合物P中既含有离子键又含有共价键
D.W、X、Y三种元素形成的物质的水溶液显碱性
【答案】B
【解析】
X与Y可形成一种淡黄色物质P,则P是Na2O2,X的原子序数比Y小,则X是O,Y是Na;
Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质,则Z为Mg,W为C,Mg在CO2中燃烧生成白色的MgO和黑色的C;
综上所述,W、X、Y、Z分别为:C、O、Na、Mg,据此分析解答。
A. X、Y、Z分别为O、Na、Mg,其简单离子分别为:O2-、Na+、Mg2+,它们核外电子排布相同,则原子序小离子半径大,故有离子半径O2->Na+>Mg2+,A正确;
B.碳的氢化物为烃,烃有很多,其沸点可能高于氧的氢化物,B错误;
C.P为Na2O2,既含有离子键又含有共价键,C正确;
D.W、X、Y三种元素形成的物质为Na2CO3或Na2C2O4,其水溶液显碱性,D正确。
答案选B。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】党的十九大报告中多次提及“绿色环保”“生态文明”,而CO2的有效利用可以缓解温室效应,解决能源短缺问题。中科院大连化学物理研究所的科研人员在新型纳米催化剂Na—Fe3O4和HMCM—22的表面将CO2转化为烷烃,其过程如图。
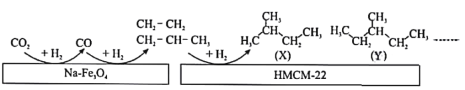
上图中CO2转化为CO的反应为:CO2(g)+H2(g)=CO(g)+H2O(g) △H =+41kJ/mol
已知:2CO2(g)+6H2(g)= C2H4(g)+ 4H2O(g) △H =-128kJ/mol
(1)图中CO转化为C2H4的热化学方程式是______________________。
(2)Fe3O4是水煤气变换反应的常用催化剂,可经CO、H2还原Fe2O3制得。两次实验结果如表所示:
实验I | 实验II | |
通入气体 | CO、H2 | CO、H2、H2O(g) |
固体产物 | Fe3O4、Fe | Fe3O4 |
结合化学方程式解释H2O(g)的作用______________________。
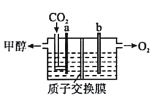
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如图所示,电极a接电源的____________极(填“正”或“负”),生成甲醇的电极反应式是______________________。
(4)用CO、H2生成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
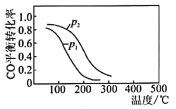
①△H2______________(填“>”“<”“=”)0。
②写出两条可同时提高反应速率和CO转化率的措施______________________________________。
③下列说法正确的是___________(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充人稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④0~3min内用CH3OH表示的反应速率v(CH3OH)=____________mol·L-1·min-1
⑤200℃时,该反应的平衡常数K=_____________。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变则化学平衡__________(填“正向”“逆向”或“不”)移动。