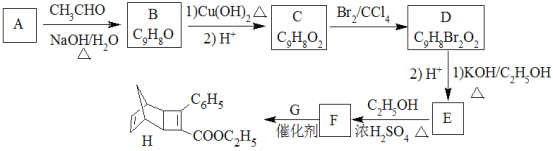
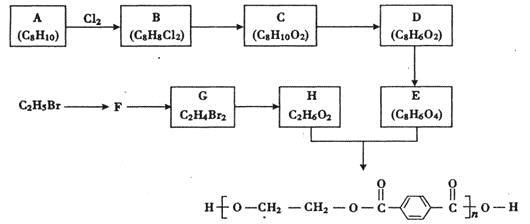
题目内容
【题目】为探究不溶性盐X(仅含四种元素)的组成和性质,设计并完成如图实验:
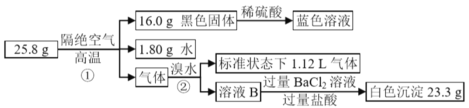
请回答:
(1)X的化学式为______________。
(2)请写出反应①的化学方程式:______________。
(3)请写出反应②的离子方程式:______________。
【答案】Cu2(OH)2SO4或CuSO4·Cu(OH)2 2Cu2(OH)2SO4![]() 4CuO+2SO2↑+O2↑+2H2O SO2+Br2+2H2O=
4CuO+2SO2↑+O2↑+2H2O SO2+Br2+2H2O=![]() +2Brˉ+4H+
+2Brˉ+4H+
【解析】
黑色固体高温下能与稀硫酸反应生成蓝色溶液,说明黑色固体是CuO16.0g,物质的量n=![]() =0.2mol,所以原来的X中含有Cu、O元素,分解得到CuO0.2mol,同时得到水的物质的量是
=0.2mol,所以原来的X中含有Cu、O元素,分解得到CuO0.2mol,同时得到水的物质的量是![]() =0.1mol,所以X成分中含H元素,得到的气体和溴水反应得到的溶液剂加入氯化钡得到白色不溶于盐酸的白色的沉淀,该沉淀是硫酸钡,物质的量是
=0.1mol,所以X成分中含H元素,得到的气体和溴水反应得到的溶液剂加入氯化钡得到白色不溶于盐酸的白色的沉淀,该沉淀是硫酸钡,物质的量是![]() =0.1mol,硫酸根的产生证明得到的气体是二氧化硫,二氧化硫和溴水反应得到硫酸,所以X成分中含S元素;另外剩余气体A的质量为25.8g16g1.8g64g/mol×0.1mol=1.6g,其物质的量为
=0.1mol,硫酸根的产生证明得到的气体是二氧化硫,二氧化硫和溴水反应得到硫酸,所以X成分中含S元素;另外剩余气体A的质量为25.8g16g1.8g64g/mol×0.1mol=1.6g,其物质的量为![]() =0.05mol,则其摩尔质量为
=0.05mol,则其摩尔质量为![]() =32g/mol,故气体A为氧气,由此可知含有的四种元素是Cu、O、H、S,分解X得到CuO、水、二氧化硫和氧气,根据原子守恒,此物质X是Cu2(OH)2SO4或CuSO4·Cu(OH)2,
=32g/mol,故气体A为氧气,由此可知含有的四种元素是Cu、O、H、S,分解X得到CuO、水、二氧化硫和氧气,根据原子守恒,此物质X是Cu2(OH)2SO4或CuSO4·Cu(OH)2,
(1)X的化学式为Cu2(OH)2SO4或CuSO4·Cu(OH)2,故答案为:Cu2(OH)2SO4或CuSO4·Cu(OH)2;
(2)反应①的方程式为:2Cu2(OH)2SO4![]() 4CuO+2SO2↑+O2↑+2H2O,故答案为:2Cu2(OH)2SO4
4CuO+2SO2↑+O2↑+2H2O,故答案为:2Cu2(OH)2SO4![]() 4CuO+2SO2↑+O2↑+2H2O;
4CuO+2SO2↑+O2↑+2H2O;
(3)二氧化硫和溴水反应得到硫酸和氢溴酸,反应的离子方程式为:SO2+Br2+2H2O=![]() +2Brˉ+4H+,故答案为:SO2+Br2+2H2O=
+2Brˉ+4H+,故答案为:SO2+Br2+2H2O=![]() +2Brˉ+4H+。
+2Brˉ+4H+。

 名校课堂系列答案
名校课堂系列答案【题目】党的十九大报告中多次提及“绿色环保”“生态文明”,而CO2的有效利用可以缓解温室效应,解决能源短缺问题。中科院大连化学物理研究所的科研人员在新型纳米催化剂Na—Fe3O4和HMCM—22的表面将CO2转化为烷烃,其过程如图。
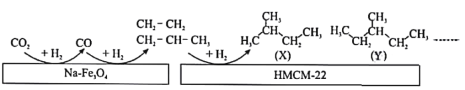
上图中CO2转化为CO的反应为:CO2(g)+H2(g)=CO(g)+H2O(g) △H =+41kJ/mol
已知:2CO2(g)+6H2(g)= C2H4(g)+ 4H2O(g) △H =-128kJ/mol
(1)图中CO转化为C2H4的热化学方程式是______________________。
(2)Fe3O4是水煤气变换反应的常用催化剂,可经CO、H2还原Fe2O3制得。两次实验结果如表所示:
实验I | 实验II | |
通入气体 | CO、H2 | CO、H2、H2O(g) |
固体产物 | Fe3O4、Fe | Fe3O4 |
结合化学方程式解释H2O(g)的作用______________________。
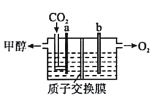
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如图所示,电极a接电源的____________极(填“正”或“负”),生成甲醇的电极反应式是______________________。
(4)用CO、H2生成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
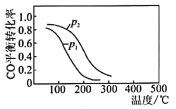
①△H2______________(填“>”“<”“=”)0。
②写出两条可同时提高反应速率和CO转化率的措施______________________________________。
③下列说法正确的是___________(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充人稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④0~3min内用CH3OH表示的反应速率v(CH3OH)=____________mol·L-1·min-1
⑤200℃时,该反应的平衡常数K=_____________。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变则化学平衡__________(填“正向”“逆向”或“不”)移动。