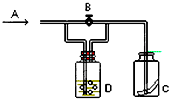
题目内容
【题目】某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( ) 
A.稀H2SO4
B.Na2SO4溶液
C.Na2CO3溶液
D.Na2SiO3溶液
【答案】C
【解析】解:根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成同主族元素非金属性强弱比较的实验研究,硫酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,依据强酸制弱酸来设计反应,所以A为稀硫酸,B为碳酸钠,C为硅酸钠溶液,硫酸与碳酸钠反应生成二氧化碳,二氧化碳通入硅酸钠溶液中,生成硅酸沉淀, 故选C.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.2000molL﹣1的氢氧化钠溶液(指示剂为酚酞),滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为molL﹣1 .
(2)达到滴定终点的标志是 .
(3)以下操作造成测定结果偏高的原因可能是 .
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,部分元素在周期表中的位置关系如右图所示.其中X是周期表中原子半径最小的元素,Q与X同主族;Z的最外层电子数是次外层的3倍.
Y | Z | ||
R |
请回答下列问题:
(1)写出Y元素的名称: , Q的原子结构示意图;R在周期表中的位置为 .
(2)Q2Z电子式为: , Q2Z2含的化学键类型为: .
(3)R、Z分别形成简单离子的半径大小:(离子符号表示)
(4)Y的氢化物与其最高价氧化物对应的水化物反应的化学方程式为: .