题目内容
烧过菜的铁锅未及时洗去含有NaCl的残液,过一段时间便出现红棕色的铁锈斑点,已知该锈斑为Fe(OH)3失水的产物。铁锅的锈蚀主要属于 (填“析氢”或“吸氧”)腐蚀。
(1)请你表示此时Fe被腐蚀的电极反应式:负极 ,正极 .
(2)Fe2+和NaOH溶液反应生成Fe(OH)2的离子方程式
(3)发生原电池反应生成Fe(OH)2的总反应式为
(4)Fe(OH)2与O2和水反应转化为Fe(OH)3,然后进一步转化为铁锈的化学方程式:
。
(1)请你表示此时Fe被腐蚀的电极反应式:负极 ,正极 .
(2)Fe2+和NaOH溶液反应生成Fe(OH)2的离子方程式
(3)发生原电池反应生成Fe(OH)2的总反应式为
(4)Fe(OH)2与O2和水反应转化为Fe(OH)3,然后进一步转化为铁锈的化学方程式:
。
吸氧 (1) 2Fe→2Fe2++4e- 2H2O+O2+4e-→4OH-
(2)Fe2++2OH-=Fe(OH)2↓ (3)2Fe+2H2O+O2=2Fe(OH)2
(4)4Fe(OH)2+2H2O+O2=4Fe(OH)3 2Fe(OH)3=Fe2O3.xH2O+(3-x)H2O
(2)Fe2++2OH-=Fe(OH)2↓ (3)2Fe+2H2O+O2=2Fe(OH)2
(4)4Fe(OH)2+2H2O+O2=4Fe(OH)3 2Fe(OH)3=Fe2O3.xH2O+(3-x)H2O
试题分析:金属腐蚀分为化学腐蚀和电化学腐蚀,其中以电化学腐蚀为主。在电化学腐蚀中又以吸氧腐蚀为主。
(1)Fe被腐蚀时负极是铁失去电子,正极是氧气得到电子,电极反应式分别是负极:2Fe→2Fe2++4e-,正极:2H2O+O2+4e-→4OH-。
(2)Fe2+和NaOH溶液反应生成Fe(OH)2的离子方程式是Fe2++2OH-=Fe(OH)2↓。
(3)根据以上分析可知,发生原电池反应生成Fe(OH)2的总反应式为2Fe+2H2O+O2=2Fe(OH)2。
(4)氢氧化亚铁不稳定,极易被氧化生成氢氧化铁。氢氧化铁失去水,即变成铁锈,即反应的方程式分别是4Fe(OH)2+2H2O+O2=4Fe(OH)3、2Fe(OH)3=Fe2O3.xH2O+(3-x)H2O
点评:该题是基础性试题的考查,难度不大。主要是考查学生对金属腐蚀的了解掌握程度,有利于调动学生的学习兴趣,提高学生应试能力和学习效率。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 4OH-
4OH-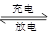 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法错误的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法错误的是 下列说法中正确的是
下列说法中正确的是

 2PbSO4+2H2O
2PbSO4+2H2O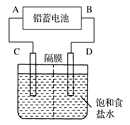
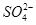 -2e-===PbSO4
-2e-===PbSO4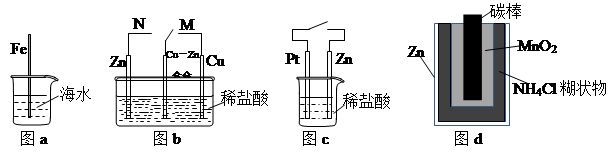
 CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。

