题目内容
(12分).铅蓄电池是典型的可充型电池,电池总反应式为:
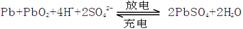
请回答下列问题(不考虑氢、氧的氧化还原):
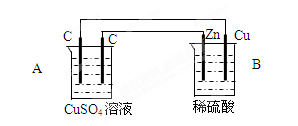
(1)放电时:正极的电极反应式是______________________ ;电解液中H2SO4的浓度将变 ______ ;当外电路通过1 mol电子时,理论上负极板的质量增加 _______ g。
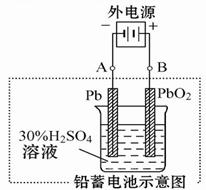
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成 _____ ___ ,电极反应:__________________ ,B电极反应_______________。
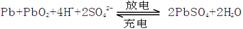

请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是______________________ ;电解液中H2SO4的浓度将变 ______ ;当外电路通过1 mol电子时,理论上负极板的质量增加 _______ g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成 _____ ___ ,电极反应:__________________ ,B电极反应_______________。
(12分,每空2分)
(1)PbO2+2e-+4H++ SO42- = PbSO4 + 2H2O 、小 、 48
(2)Pb A极反应: PbSO4+2e- =" Pb" + SO42-
B极反应: PbSO4+2H2O-2e- = PbO2+4H++ SO42-
(1)PbO2+2e-+4H++ SO42- = PbSO4 + 2H2O 、小 、 48
(2)Pb A极反应: PbSO4+2e- =" Pb" + SO42-
B极反应: PbSO4+2H2O-2e- = PbO2+4H++ SO42-
试题分析:(1)原电池中正极得到电子,发生还原反应。所以根据放电时的方程式可知,正极的电极反应式是PbO2+2e-+4H++ SO42- = PbSO4 + 2H2O。放电是消耗硫酸的,所以硫酸的浓度变小。负极失去电子,发生氧化反应,所以负极电极反应式是Pb-2e-+ SO42- = PbSO4,所以当外电路通过1 mol电子时,理论上负极板的质量增加96g/mol×0.5mol=48g。
(2)根据装置图可知,A电极和电源的负极相连,作阴极,得到电子,所以是二氧化铅得到电子生成单质铅,电极反应式是bSO4+2e- =" Pb" + SO42-。B电极和电源的正极相连,作阳极,硫酸铅失去电子,得到二氧化铅,电极反应式是PbSO4+2H2O-2e- = PbO2+4H++ SO42-。
点评:书写电极反应式的关键是准确判断出原电池的正负极、电解池的阴阳极等。而在电化学的有关计算时,往往常用电子得失守恒。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
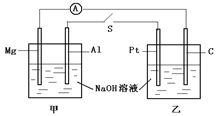
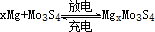 ,下列说法不正确的是( )
,下列说法不正确的是( )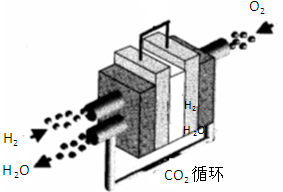
 Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。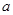 g M,则金属M的相对原子质量为 (用含“
g M,则金属M的相对原子质量为 (用含“