题目内容
(1)用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑。则铁锅的锈蚀属于 腐蚀(填“析氢”或“吸氧”);该腐蚀正极的电极反应式为 ;
此反应每转移2mol电子消耗的O2在标准状况下的体积为 L。
(2)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4 CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
此反应每转移2mol电子消耗的O2在标准状况下的体积为 L。
(2)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4
 CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
(1)吸氧 2H2O+O2+4e-=4OH- 11.2L
(2)如右图(图正确1分,标注1分)
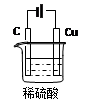
两极与电源的正负极接反了(或铜棒接电源的负极等)
(2)如右图(图正确1分,标注1分)

两极与电源的正负极接反了(或铜棒接电源的负极等)
试题分析:(1)红褐色锈斑的主要成分是Fe(OH)3,其主要是由于铁发生吸氧腐蚀时产生的。其发生的过程为:①正极反应:2H2O+O2+4e-=4OH-,负极反应:Fe-2e-=Fe2+;②4Fe(OH)2+2H2O+O2=4Fe(OH)3。由正极反应式可知,当转移2mol电子时,消耗的氧气的量为0.5mol,因此在标准状态下的体积为
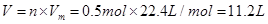 。
。(2)由题可知,实现这一反应的装置应为电解池装置,且铜做为阳极。因此该装置图如下:

“某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀”铜棒没被腐蚀,说明此时铜棒应作为了阴极。
点评:本题综合考查了“原电池”与“电解池”等内容,属于基础题,也是高考的重要考点。本题的难点在于第二问对装置的判断。对于此种题型,应充分利用化学方程式,判断反应进行的难易以及氧化反应、还原反应,即可得出结论。

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
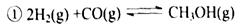


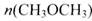 =_________mol。
=_________mol。
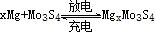 ,下列说法不正确的是( )
,下列说法不正确的是( )