题目内容
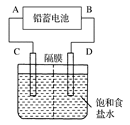
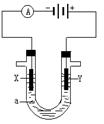
下图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
已知:铅蓄电池在放电时发生下列电极反应
负极 Pb+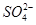 -2e-===PbSO4
-2e-===PbSO4
正极 PbO2+4H++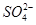 +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式 。
(2)若在电解池中C极一侧滴2滴酚酞试液,电解一段时间后未呈红色,说明蓄电池的A极为________极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量、密度为1.15 g·cm-3)时,
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。

已知:铅蓄电池在放电时发生下列电极反应
负极 Pb+
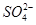 -2e-===PbSO4
-2e-===PbSO4正极 PbO2+4H++
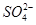 +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O(1)请写出电解饱和食盐水的化学方程式 。
(2)若在电解池中C极一侧滴2滴酚酞试液,电解一段时间后未呈红色,说明蓄电池的A极为________极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量、密度为1.15 g·cm-3)时,
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。
(8分)(1)2NaCl+2H2O 2NaOH+Cl2↑+H2↑ (2)正 (3)①1 ②22.4
2NaOH+Cl2↑+H2↑ (2)正 (3)①1 ②22.4
 2NaOH+Cl2↑+H2↑ (2)正 (3)①1 ②22.4
2NaOH+Cl2↑+H2↑ (2)正 (3)①1 ②22.4试题分析:(1)惰性电极电解饱和食盐水的化学方程式为2NaCl+2H2O
 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。(2)若在电解池中C极一侧滴2滴酚酞试液,电解一段时间后未呈红色,这说明C电极应该是电解池的阳极,溶液中的氯离子放电,所以蓄电池的A极为正极。
(3)①氯气的物质的量是11.2L÷22.4L/mol=0.5mol,则根据电极反应式2Cl--2e-=Cl2↑可知,反应中转移电子的物质的量是0.5mol×2=1.0mol。
②根据蓄电池的电极反应式可知,消耗2mol硫酸,反应中就转移2mol电子。所以若蓄电池消耗H2SO4 2 mol,则反应中转移2mol电子,因此根据电极反应式2H++2e-=H2↑可知,可收集到H2的物质的量是1mol,其体积(标准状况下)为22.4L。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固与训练,有利于培养学生灵活运用基础知识解决实际问题的能力,有助于提高学生的应试能力和学习效率。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
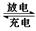 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)

 电极上发生还原反应
电极上发生还原反应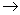 a
a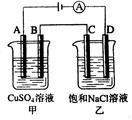
 Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。 g M,则金属M的相对原子质量为 (用含“
g M,则金属M的相对原子质量为 (用含“