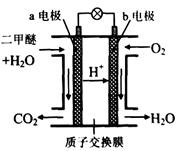
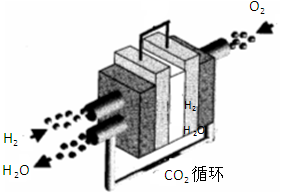
题目内容
汽车上用的铅蓄电池是以一组充满海绵状态的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。总反应为:Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
下列叙述正确的是
 2PbSO4+2H2O
2PbSO4+2H2O下列叙述正确的是
| A.充电时阴极反应为:Pb + SO42- -2e- =PbSO4 |
| B.放电时,当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为1mol |
| C.放电时溶液中H+向负极移动 |
| D.充电时阳极附近溶液的pH减小 |
D
试题分析:充电相当于是电解,阴极得到电子,A不正确,应该是PbSO4+2e-=Pb+SO42 -。放电相当于是原电池,根据方程式可知,消耗2mol硫酸时,转移2mol电子,B不正确;原电池中阳离子向正极移动,选项C不正确;充电时阳极失去电子,电极反应式是PbSO4-2e-+2H2O=PbO2+4H++SO42 -,这说明充电时阳极附近溶液的pH减小,答案选D。
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。在注重对学生基础知识巩固和训练的同时,侧重对学生答题能力的培养和训练,旨在考查学生电化学原理解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力。该题的关键是明确原电池和电解池的工作原理,然后结合题意灵活运用即可。

练习册系列答案
相关题目
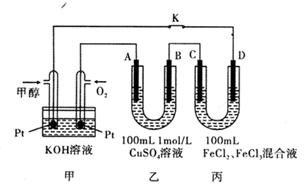
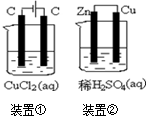

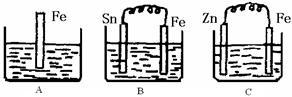
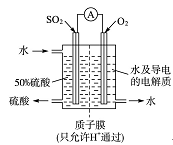
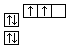 转变为
转变为 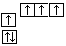 时,碳原子要向外界环境吸收能量
时,碳原子要向外界环境吸收能量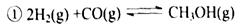


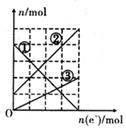
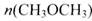 =_________mol。
=_________mol。