��Ŀ����
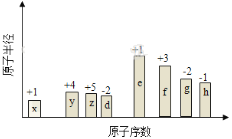
����Ŀ��������Ԫ��X��Y��Z��W�����ڱ��е�λ�ù�ϵ����ͼ��ʾ����֪��ͬ����Ԫ�صij����������У�W�ļ����Ӱ뾶��С��X��Y��Z��W�ĵ��ʼ��仯�������ճ���������;����㷺��
��1��XԪ����Ԫ�����ڱ��е�λ��________________��
��2��X��Y��ZԪ�ص��⻯��������ֻ��������ϣ�����һ�������£�Һ̬YH3��Һ̬H2Z���Է������Ʒ�ʽ���룬��Һ̬YH3�������ӵĵ���ʽΪ_________��
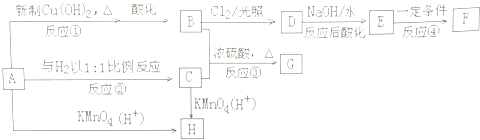
��3����ϸWY��ĩ��Ӧ���ڴ��ģ���ɵ�·����������ԭ��ΪW2Z3��Y2��X�ڸ����·�Ӧ�������ֻ���������ֻ������������Ԫ����ɣ���ԭ�Ӹ����Ⱦ�Ϊ1��1���䷴Ӧ�Ļ�ѧ����ʽΪ_______________��
��4����WΪ�����Ƴɵ������ڿ����о������ұ������ã���������_____�������������������������������̲ˣ�ԭ����____________________________��
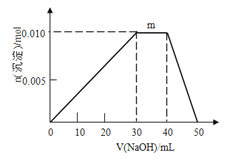
��5��ij����β����������ȼ�ϵ��Ϊ����ԭ���ⶨXZ��Ũ�ȣ���װ����ͼ��ʾ���õ���е����Ϊ�����ƣ������ƣ�����Z2-�����ڹ������NASICON�������ƶ������ķ�Ӧʽ_____________________________________�����ڸõ�ص�����˵������ȷ����_______

A������ʱ�缫b��������Z2- ͨ���������NASICON�ɵ缫b����缫a
B������ʱ�����ɵ缫aͨ������������缫b
C����������ͨ���ĵ���Խ��β����XZ�ĺ���Խ��
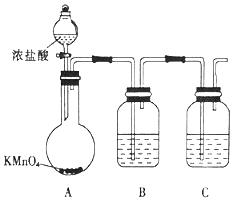
��6����Ԫ��X��Ԫ��Z��ɵ�ij�������Ӿ��л�ԭ�����Ӧ���᳣��������Ȼ���е�ֲ���У��ܱ�����KMnO4����������д��Ӧ�����ӣ���������ƽ��_________________
![]()
���𰸡� �ڶ�����2��������A �� ![]() Al2O3 + N2 + 3C
Al2O3 + N2 + 3C ![]() 2AlN + 3CO ���� �����ӻ��ƻ�����������Ĥ CO + O2- �D2e-��CO2 AC
2AlN + 3CO ���� �����ӻ��ƻ�����������Ĥ CO + O2- �D2e-��CO2 AC ![]()
�����������������������Ԫ��X��Y��Z��W�����ڱ��е�λ�ù�ϵ��ͼ��ʾ����֪��ͬ����Ԫ�صij����������У�W�ļ����Ӱ뾶��С������Ԫ�ص����λ�ÿ�֪��WӦ���ǵ�������Ԫ�أ�����Wһ������Ԫ�أ���X��Y��Z�ֱ���C��N��O��
��1��̼Ԫ����Ԫ�����ڱ��е�λ���ǵڶ����ڵ���A �塣
��2��һ�������£�Һ̬YH3��Һ̬H2Z���Է������Ʒ�ʽ���룬�����ˮ�ĵ��뷽��ʽH2O��H2O![]() H3O����OH����֪��Һ̬YH3�ĵ��뷽��ʽΪNH3��NH3
H3O����OH����֪��Һ̬YH3�ĵ��뷽��ʽΪNH3��NH3![]() NH4����NH2������������ӵĵ���ʽΪ
NH4����NH2������������ӵĵ���ʽΪ ��
��
��3������ԭ��ΪW2Z3��Y2��X�ڸ����·�Ӧ�������ֻ���������ֻ������������Ԫ����ɣ���ԭ�Ӹ����Ⱦ�Ϊ1��1��������ԭ���غ��֪�����ֻ�����Ӧ����AlN��CO�������䷴Ӧ�Ļ�ѧ����ʽΪAl2O3 + N2 + 3C![]() 2AlN + 3CO��
2AlN + 3CO��
��4�������̲��к��д����������ӣ��������ӻ��ƻ�����������Ĥ�����Ը������������������̲ˡ�
��5��ԭ����нϻ��õĽ����Ǹ�����ʧȥ���ӣ�����������Ӧ�����Ӿ����ߴ��ݵ�������������Һ�е��������������ƶ��������õ����ӣ�������ԭ��Ӧ�������ڸ�ԭ�����CO�ڸ���ͨ�뷢��������Ӧ����CO2������������ͨ�������õ���������O2-��O2-���������������Ը����缫��ӦʽΪCO + O2-�D2e-��CO2��A������ʱ�缫b��������Z2- ͨ���������NASICON�ɵ缫b����缫a��A��ȷ��B������ʱ�����ɵ缫bͨ������������缫a��B����ȷ��C����������ͨ���ĵ���Խ�����ĵ�COԽ�࣬��˵��β����XZ�ĺ���Խ�ߣ�C��ȷ����ѡAC��
��6��Ԫ��X��Ԫ��Z��ɵ�ij�������Ӿ��л�ԭ�ԣ��ܱ�����KMnO4����������������C2O42������Ӧ��̼Ԫ�صĻ��ϼ۴�+3�����ߵ�+4��ʧȥ1�����ӣ���MnԪ�صĻ��ϼ۴�+7�۽��͵�+2�۵õ�5�����ӣ���˸��ݵ��ӵ�ʧ�غ��֪�������뻹ԭ�������ʵ���֮����2:5�������ԭ���غ��֪����ƽ��ķ���ʽΪ5C2O42����2MnO4����16H��=10CO2��2Mn2����8H2O��

 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�