��Ŀ����
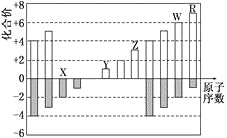
����Ŀ����������A��H��ת����ϵ��ͼ��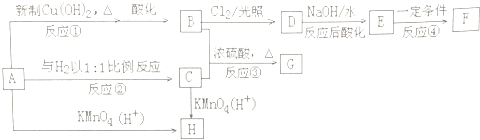
��A�ķ���ʽΪC8H8O���䱽���ϵ�һ�����ֻ�����֣�FΪ�߷��ӻ������ش��������⣺
��1����Ӧ�ڵķ�Ӧ������ �� D�к��������ŵ������� ��
��2��д���й����ʵĽṹ��ʽ��E �� H ��
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��A������Cu��OH��2�ķ�Ӧ��B+C��G ��
��4��B��ͬ���칹������������ķ����廯���ﹲ��6�֣������������֣���д��������ͬ���칹��Ľṹ��ʽ���� �� ![]()
��5��E��һ��ͬ���칹�屽��������һ�ֻ�����Ʒ��������Ŀ���й���Ϣ������Ա���ϩΪԭ�ϣ��Ʊ���������ĺϳ�·�ߣ�������ͼ��ʾ�����Լ���ѡ����ע���ϳ�·�ߵ���д��ʽ��������ʾ������ͼ��
CH3CHO ![]() CH3COOH
CH3COOH ![]() CH3COOCH2CH3 ��
CH3COOCH2CH3 ��
���𰸡�
��1���ӳɷ�Ӧ���Ȼ�
��2��![]() ��
��![]()
��3��![]() ��
��![]()
��4��![]() ��
��![]()
��5��![]() ��
��![]()
���������⣺A�ķ���ʽΪC8H8O���ܷ���������Ӧ������ȩ���������Ͷ�= ![]() =5���䱽���ϵ�һԪȡ����ֻ�����֣���2�������Ҵ��ڶ�λ����AΪ
=5���䱽���ϵ�һԪȡ����ֻ�����֣���2�������Ҵ��ڶ�λ����AΪ ![]() ��A������������ͭ�����������·���������Ӧ���ữ�õ�B����BΪ
��A������������ͭ�����������·���������Ӧ���ữ�õ�B����BΪ ![]() ��A������1��1�����ӳɷ�Ӧ����C����CΪ
��A������1��1�����ӳɷ�Ӧ����C����CΪ ![]() ��A�����Ը��������������H��C����Ҳ����H����HΪ
��A�����Ը��������������H��C����Ҳ����H����HΪ ![]() ��B��C��Ũ���ᡢ���������·���������Ӧ����G����GΪ
��B��C��Ũ���ᡢ���������·���������Ӧ����G����GΪ ![]() ��B���շ�������ȡ����Ӧ����D��D����������ˮ��Һ��������������ˮ�ⷴӦ�����ữ����E��E���ɵ�FΪ�߷��ӻ������E�к��Щ�OH����COOH����B����һ��ȡ������D����DΪ
��B���շ�������ȡ����Ӧ����D��D����������ˮ��Һ��������������ˮ�ⷴӦ�����ữ����E��E���ɵ�FΪ�߷��ӻ������E�к��Щ�OH����COOH����B����һ��ȡ������D����DΪ ![]() ����EΪ
����EΪ ![]() ��E�������۷�Ӧ����F����FΪ
��E�������۷�Ӧ����F����FΪ ![]() ����1����Ӧ�����ڼӳɷ�Ӧ��DΪ
����1����Ӧ�����ڼӳɷ�Ӧ��DΪ ![]() ������������Ϊ�Ȼ������Դ��ǣ��ӳɷ�Ӧ���Ȼ�����2��������������֪��EΪ
������������Ϊ�Ȼ������Դ��ǣ��ӳɷ�Ӧ���Ȼ�����2��������������֪��EΪ ![]() ��HΪ
��HΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
�� ![]() ����3��A������C��OH��2����Һ�ķ�Ӧ��Ӧ����ʽΪ��
����3��A������C��OH��2����Һ�ķ�Ӧ��Ӧ����ʽΪ�� ![]() �� B+C��G��Ӧ����ʽΪ��
�� B+C��G��Ӧ����ʽΪ�� ![]() ��
��
���Դ��ǣ� ![]() ��
�� ![]() ����4��B��
����4��B�� ![]() ����ͬ���칹������������ķ����廯�����ͬ���칹�壬��������ͬ���칹��Ľṹ��ʽ��
����ͬ���칹������������ķ����廯�����ͬ���칹�壬��������ͬ���칹��Ľṹ��ʽ�� ![]() ��
�� ![]() ��
�� ![]() ��
�� ![]() ������2����
������2���� ![]() ��
�� ![]() ��
��
���Դ��ǣ� ![]() ��
�� ![]() ����5��E��
����5��E�� ![]() ����һ��ͬ���칹�屽�����ᣨ
����һ��ͬ���칹�屽�����ᣨ ![]() ����һ�ֻ�����Ʒ��������Ŀ���й���Ϣ�������
����һ�ֻ�����Ʒ��������Ŀ���й���Ϣ�������
����ϩ�� ![]() �����巢���ӳɷ�Ӧ
�����巢���ӳɷ�Ӧ ![]() ������������ˮ��Һ���������·���ˮ�ⷴӦ�õ�
������������ˮ��Һ���������·���ˮ�ⷴӦ�õ� ![]() ������������Ӧ��Ӧ�õ�
������������Ӧ��Ӧ�õ� ![]() ����һ������Ϊ
����һ������Ϊ ![]() ��������ӳɷ�Ӧ�õ�
��������ӳɷ�Ӧ�õ� ![]() ���ϳ�·������ͼΪ��
���ϳ�·������ͼΪ�� ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ��
��
���Դ��ǣ� ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ��
��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����������һ����Ҫ�����ȼ�ϣ�Ҳ�������������������ȣ��Գ��������ƻ����á���ҵ�Ͽ�����ú���������ˮú�����ϳɶ����ѡ�
��ش��������⣺
��1��ú����������Ҫ��ѧ��Ӧ����ʽΪ��___________________________��
��2��ú�����������в������к�����H2S��Na2CO3��Һ���գ�����������ʽ�Σ��÷�Ӧ�Ļ�ѧ����ʽΪ��________________________________________��
��3������ˮú���ϳɶ����ѵ�������Ӧ���£�
�� 2H2(g) + CO(g) ![]() CH3OH(g)����H �� ��90.8 kJ��mol��1
CH3OH(g)����H �� ��90.8 kJ��mol��1
�� 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)����H�� ��23.5 kJ��mol��1
CH3OCH3(g) + H2O(g)����H�� ��23.5 kJ��mol��1
�� CO(g) + H2O(g) ![]() CO2(g) + H2(g)����H�� ��41.3 kJ��mol��1
CO2(g) + H2(g)����H�� ��41.3 kJ��mol��1
�ܷ�Ӧ��3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2 (g)����H�� ___________��
CH3OCH3(g) + CO2 (g)����H�� ___________��
һ�������µ��ܱ������У����ܷ�Ӧ�ﵽƽ�⣬Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��__________������ĸ���ţ�
a�����¸�ѹ b��������� c������CO2��Ũ��
d������CO��Ũ�� e�������������
��4����֪��Ӧ��2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)ij�¶��µ�ƽ�ⳣ��Ϊ400 �����¶��£����ܱ������м���CH3OH ����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OCH3(g) + H2O(g)ij�¶��µ�ƽ�ⳣ��Ϊ400 �����¶��£����ܱ������м���CH3OH ����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
Ũ��/��mol��L��1�� | 0.44 | 0.6 | 0.6 |
�� �Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С��v�� ______ v�� ������>������<����������)��
�� ������CH3OH��10 min��Ӧ�ﵽƽ�⣬��ʱc(CH3OH) �� _________����ʱ���ڷ�Ӧ����v(CH3OH) �� __________���ﵽƽ��ʱ�״���ת��������CH3OH��= _________