题目内容
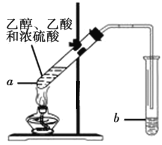
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.
 ℃
℃
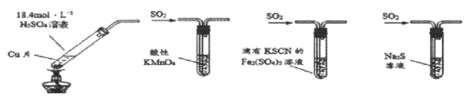
(1)写出实验室制备乙酸乙酯的化学方程式_________
(2)步骤②中b试管中饱和Na2CO3溶液的主要作用_______(填字母)
a.降低乙酸乙酯的溶解度
b.除去实验中挥发出来的硫酸
c.除去乙酸乙酯中混有的乙酸和乙醇
(3)试管b中盛放的试剂_________(填“能”或“不能”)换成NaOH溶液
(4)连接好装置(装置气密性良好),用小火均匀地加热装有混合液的试管a3~5min,需要用小火均匀加热,其主要原因是________
【答案】CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O a、c 不能 减少原料损失,减少副产物
CH3COOCH2CH3+H2O a、c 不能 减少原料损失,减少副产物
【解析】
实验室用乙酸和乙醇在浓硫酸加热条件下反应生成乙酸乙酯,用饱和碳酸钠溶液除去乙酸和乙醇,并降低乙酸乙酯的溶解度,增大水的密度,使酯浮于水面,容易分层析出,便于分离,据此分析解答。
(1)实验室用乙酸和乙醇在浓硫酸加热条件下反应生成乙酸乙酯,化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(2)根据分析,b试管中饱和Na2CO3溶液除去乙酸和乙醇,并降低乙酸乙酯的溶解度,增大水的密度,使酯浮于水面,容易分层析出,便于分离,答案选a、c;
(3)试管b中盛放的试剂不能换成NaOH溶液,因为碱性条件下生成的乙酸乙酯会发生水解;
(4)乙酸和乙醇具有挥发性,温度过高会增大原料损失,同时高温下乙醇在浓硫酸作用下会发生分子间脱水生成乙醚或发生消去反应生成乙烯,导致副产物增多,则需要用小火均匀加热的原因是减少原料损失,减少副产物。

练习册系列答案
相关题目