题目内容
【题目】浓度均为0.01molL-1的盐酸(A)、醋酸溶液(B)、氢氧化钠溶液(C):
(1)写出B溶液中醋酸的电离方程式:______________。上述溶液稀释10倍后pH减小的是______________(填字母)。
(2)取等体积的A、B两溶液分别加入过量的锌粉,反应开始时放出H2的速率依次为a1、a2,则a1______________(填“>”“<”或“=”,下同)a2。反应结束时放出H2的物质的量为n1、n2,则n1______________n2。
(3)完全中和体积与物质的量浓度均相同的两份C溶液时,需A、B两溶液的体积依次为V1、V2则V1______________V2;若完全中和体积与pH均相同的A、B两溶液时消耗C溶液的体积分别为V(A)、V(B),则V(A)______________V(B)。
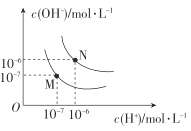
(4)图中M点表示25℃时水在电离平衡时的离子浓度N点表示T℃时水在电离平衡时的离子浓度。T℃时,3×10-3molL-1的氢氧化钠溶液与1×10-3molL-1盐酸等体积混合后溶液的pH=______________。
【答案】CH3COOH![]() CH3COO-+H+ C > = = < 9
CH3COO-+H+ C > = = < 9
【解析】
(1)醋酸是弱电解质,醋酸的电离可逆;加水稀释,酸的pH升高、碱溶液的pH降低;
(2)0.01molL-1的盐酸中氢离子浓度大于0.01molL-1的醋酸;同浓度、同体积的盐酸、醋酸中溶质的物质的量相同;
(3)完全中和体积与物质的量浓度均相同的两份氢氧化钠溶液时,消耗盐酸、醋酸的物质的量相等;pH均相同的盐酸、醋酸,醋酸浓度大于盐酸;
(4)N点表示T℃时水的离子积,则T℃时水的离子积常数是10-12;
(1)醋酸是弱电解质,醋酸的电离方程式是CH3COOH![]() CH3COO-+H+;盐酸、醋酸的pH小于7,加水稀释pH增大;氢氧化钠溶液的pH大于7,加水稀释pH减小,故选C;
CH3COO-+H+;盐酸、醋酸的pH小于7,加水稀释pH增大;氢氧化钠溶液的pH大于7,加水稀释pH减小,故选C;
(2)0.01molL-1的盐酸中氢离子浓度大于0.01molL-1的醋酸,氢离子浓度越大,反应速率越快,所以a1>a2;同浓度、同体积的盐酸、醋酸中溶质的物质的量相同,所以和锌反应放出氢气的物质的量相等,则n1=n2;
(3)完全中和体积与物质的量浓度均相同的两份氢氧化钠溶液时,消耗盐酸、醋酸的物质的量相等,盐酸、醋酸的浓度相等,所以V1=V2;pH均相同的盐酸、醋酸,醋酸浓度大于盐酸,体积与pH均相同的盐酸、醋酸两溶液,醋酸的物质的量大于盐酸,完全中和消耗氢氧化钠的体积醋酸大于盐酸,所以V(A) <V(B);
(4)T℃时水的离子积常数是10-12;T℃时,3×10-3molL-1的氢氧化钠溶液与1×10-3molL-1盐酸等体积混合,氢氧化钠有剩余,溶液中![]() =1×10-3molL-1,
=1×10-3molL-1,![]() 1×10-9molL-1,pH=9。
1×10-9molL-1,pH=9。

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案