题目内容
16.碳酸钠和碳酸氢钠的混合物14.8g,投入硝酸中完全反应,刚好消耗50g 31.5%的硝酸溶液.(1)写出反应的化学方程式;
(2)计算混合物中碳酸钠的质量分数;
(3)若将该混合物投入烧碱溶液中,消耗10%的烧碱溶液的质量为多少?
分析 (1)发生反应为:Na2CO3+2HNO3═2NaNO3+H2O+CO2↑和NaHCO3+HNO3═NaNO3+H2O+CO2↑;
(2)设碳酸钠的物质的量为xmol,碳酸氢钠的物质的量为ymol,根据混合物质量为14.8g,两者恰好完全反应生成硝酸钠,所以钠离子与硝酸根离子的物质的量相等,而50g 31.5%的硝酸溶液中硝酸的物质的量为:$\frac{50g×31.5%}{63g/mol}$=0.25mol,则2x+y=0.25,然后解得x、y,碳酸钠的质量分数为$\frac{碳酸钠的质量}{14.8g}×100%$;
(3)投入烧碱溶液中,发生NaOH+NaHCO3=Na2CO3+H2O,由反应方程式可知投入烧碱的量等于氢氧化钠的量,由此分析求解.
解答 解:(1)发生反应为:Na2CO3+2HNO3═2NaNO3+H2O+CO2↑和NaHCO3+HNO3═NaNO3+H2O+CO2↑,答:反应的化学方程式为:Na2CO3+2HNO3═2NaNO3+H2O+CO2↑和NaHCO3+HNO3═NaNO3+H2O+CO2↑;
(2)设碳酸钠的物质的量为xmol,碳酸氢钠的物质的量为ymol,所以106x+84y=14.8g,两者恰好完全反应生成硝酸钠,所以钠离子与硝酸根离子的物质的量相等,而50g 31.5%的硝酸溶液中硝酸的物质的量为:$\frac{50g×31.5%}{63g/mol}$=0.25mol,则2x+y=0.25,解得x=0.1mol、y=0.05mol,所以碳酸钠的质量分数为$\frac{碳酸钠的质量}{14.8g}×100%$=$\frac{0.1×106}{14.8}×100%$=71.6%,答:混合物中碳酸钠的质量分数为:71.6%;
(3)投入烧碱溶液中,发生NaOH+NaHCO3=Na2CO3+H2O,由反应方程式可知投入烧碱的量等于氢氧化钠的量,所以烧碱的质量为:0.05mol×40g/mol=2g,所以10%的烧碱溶液的质量为$\frac{2g}{10%}$=20g,答:消耗10%的烧碱溶液的质量为20g.
点评 本题考查混合物的计算,题目难度不大,注意碳酸氢钠和碳酸钠的性质,利用守恒法结合化学方程式计算.

| A. | 以 CH≡CH 和 HCl 反应制氯乙烯,进而制备聚氯乙烯塑料 | |
| B. | 浓氨水滴入生石灰中,将产生的气体通入 AlCl3溶液,可得到含AlO2-的溶液 | |
| C. | 使用催化剂不能改变工业合成 NH3 的反应限度 | |
| D. | 用浸有 KMnO4溶液的硅土来吸收水果释放的乙烯 |
| A. | 5:4 | B. | 4:5 | C. | 5:12 | D. | 12:5 |
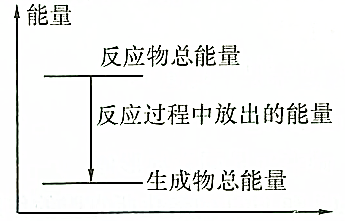
| A. | 反应过程中的能量关系可用如图表示 | |
| B. | 1mol锌所含的能量高于1mol H2 所含的能量 | |
| C. | 若将其设计为原电池,则锌为正极 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |
| A. | 二氧化碳气体通入氨水中 | B. | 二氧化硫气体通入澄清石灰水中 | ||
| C. | 五氧化二磷投入碱溶液中 | D. | 二氧化硅投入烧碱溶液中 |
| A. | CH3CH2CH2OH | B. | (CH3)3COH | C. | CH3OH | D. | CH3CH2OH |
| 选项 | 条件 | 结论 |
| A | 若X原子半径X>Y | 原子序数:X<Y |
| B | 若最高价氧化物对应水化物酸性X>Y | 元素的电负性:X>Y |
| C | 若价电子数X>Y | 最高正价:X>Y |
| D | 若X、Y最外层电子数分别为1、7 | X、Y之间一定能形成离子键 |
| A. | A | B. | B | C. | C | D. | D |