题目内容
8.配制500mL 1mol/L的H2SO4溶液,需要密度为1.836g/mL的浓硫酸(98%硫酸)多少毫升?分析 先计算浓硫酸的物质的量浓度,然后根据稀释过程中硫酸的物质的量不变进行计算需要浓硫酸溶液的体积.
解答 解:密度为1.836g/cm3,质量分数为98%的浓硫酸的物质的量浓度为:c(H2SO4)=$\frac{1000ρw}{M}$=$\frac{1000×1.836×98%}{98}$mol/L=18.4mol/L,
配制500mL 1mol/L,需要18.4mol/L浓硫酸体积为:$\frac{0.5L×1mol/L}{18.4mol/L}$≈0.0272L=27.2mL,
答:需要27.2mL的浓硫酸.
点评 本题考查了物质的量浓度计算,题目难度中等,注意物质的量浓度与溶液密度、质量分数的关系.

练习册系列答案
相关题目
18.已知C3N4晶体具有比金刚石更大的硬度,且原子间均以单键结合.下列关于C3N4晶体的说法正确的是( )
| A. | C3N4晶体是分子晶体 | |
| B. | C3N4晶体中C-N键长比金刚石中C-C要长 | |
| C. | C3N4晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子 | |
| D. | C3N4晶体中微粒间通过离子键结合 |
10.下列反应的离子方程式正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 用氯化铁溶液腐蚀电路板:Fe3++Cu═Fe2++Cu2+ |
7.联碱法(候氏制碱法)和氨碱法的生产流程简要表示如图1:

(1)两种方法的沉淀池中均发生的反应化学方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓.
(2)若沉淀池含800.00mol NH3的水溶液质量为54.00kg,向该溶液通入二氧化碳至反应完全,过滤,得到滤液31.20kg,则NH4HCO3的产率为92%.
(3)在氨碱法生产过程中氨要循环使用,但不需要补充,在母液中加生石灰前先要加热的原因是防止加石灰水时产生碳酸钙沉淀.
(4)根据联碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是bd(选填编号).
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度,使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,
联碱法的另一项优点是避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备.
(6)从沉淀池析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
①第二次滴定,从图2-Ⅰ图2-Ⅱ显示消耗的盐酸溶液体积为20.20ml.
②该实验测定NaHCO3含量的计算式为ω(NaHCO3)=10.1%.
③该同学测定结果有一定的误差,产生该误差的原因可能是cd(选填编号).
a.待测液中加入甲基橙作指示剂,用标准酸液滴定至变橙色
b.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定
c.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
d.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定.

(1)两种方法的沉淀池中均发生的反应化学方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓.
(2)若沉淀池含800.00mol NH3的水溶液质量为54.00kg,向该溶液通入二氧化碳至反应完全,过滤,得到滤液31.20kg,则NH4HCO3的产率为92%.
(3)在氨碱法生产过程中氨要循环使用,但不需要补充,在母液中加生石灰前先要加热的原因是防止加石灰水时产生碳酸钙沉淀.
(4)根据联碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是bd(选填编号).
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度,使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,
联碱法的另一项优点是避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备.
(6)从沉淀池析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
| 滴定次数 | 待测液(mL) | 0.6000mol/L盐酸溶液的体积(mL) | |
| 初读数 | 终读数 | ||
| 第一次 | 20.00 | 1.00 | 21.00 |
| 第二次 | 20.00 | 如右图Ⅰ | 如右图Ⅱ |
②该实验测定NaHCO3含量的计算式为ω(NaHCO3)=10.1%.
③该同学测定结果有一定的误差,产生该误差的原因可能是cd(选填编号).
a.待测液中加入甲基橙作指示剂,用标准酸液滴定至变橙色
b.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定
c.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
d.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定.
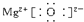 .
.