题目内容
4.对于反应Zn+H2SO4═ZnSO4 +H2 (反应放热),下列叙述正确的是( )
| A. | 反应过程中的能量关系可用如图表示 | |
| B. | 1mol锌所含的能量高于1mol H2 所含的能量 | |
| C. | 若将其设计为原电池,则锌为正极 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |
分析 A、根据放热反应中反应物的总能量大于生成物的总能量;
B、放热反应中反应物的总能量大于生成物的总能量;
C、原电池的负极失去电子;
D、根据总反应方程式以及气体的体积与状态有关来计算;.
解答 解:A、放热反应Zn+H2SO4═ZnSO4+H2↑,则反应物的总能量大于生成物的总能量,故A正确;
B、放热反应中反应物的总能量大于生成物的总能量,则无法比较1molZn与1 molH2的能量,故B错误;
C、Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)的反应中锌失去电子,化合价升高,作原电池的负极,故C错误;
D、Zn+H2SO4 =ZnSO4 +H2↑
65g 22.4L
65g 11.2L
所以32.5g锌溶解时,正极放出气体在标况下11.2L,没有说明温度和压强,气体体积不一定为11.2L,故D错误;
故选A.
点评 本题主要考查原电池原理、化学反应中的能量以及化学计算等,难度不大,根据课本知识即可完成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.A、B、C、D、E五种短周期元素,已知它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和,B原子最外层电子数比其次外层电子数多2,在元素周期表中,C是E的邻族元素,D和E的原子序数之和是30,它们两两形成的化合物有甲、乙、丙、丁四种,这四种化合物中原子个数比如表:
(1)化合物甲的电子式是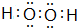 ;
;
(2)已知有机物乙的分子为平面结构,碳氢键键角为120°,当X=2时,乙的结构简式为CH2=CH2,当X=1时,乙的二氯代物结构有3种.
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:X | D和E 1:3 | B和E 1:4 |
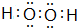 ;
;(2)已知有机物乙的分子为平面结构,碳氢键键角为120°,当X=2时,乙的结构简式为CH2=CH2,当X=1时,乙的二氯代物结构有3种.
9.物质的溶解度为S g,则它的饱和溶液的溶质的质量分数为( )
| A. | 大于S% | B. | 小于S% | C. | 等于S% | D. | 无法确定 |
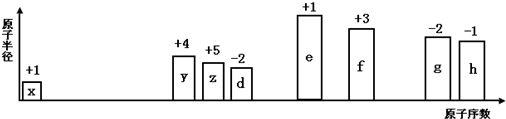
 .
.
 .
.