题目内容
【题目】请回答以下问题:
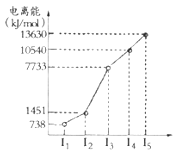
(1)第四周期的某主族元素,其第一至五电离能数据如图所示,则该元素对应原子的M层电子排布式为____________。
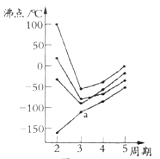
(2)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是______。
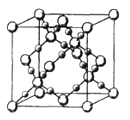
(3)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体的熔点比SiO2晶体________(填“高”或“低”),该晶体中碳原子轨道的杂化类型为______。
(4)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为____(填序号)。
A.离子键 B.配位键 C.氢键 D.非极性共价键
若化合物(CH3)3N能溶于水,试解释其原因:_________________________。
(5)一种新型储氢化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为__________________(若含有配位键,要求用箭头表示)
(6)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为______________________;正四面体形阳离子中键角小于PCl3的键角原因为_____________________________;若PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因______________________。
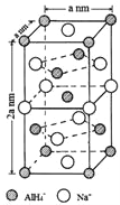
(7)氢化铝钠(NaAlH4)是一种新型轻质材料, NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如下图所示。NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有_________个;NaAlH4晶体的密度为___________g·cm-3(用含a的代数式表示)。
【答案】 3s23p6 SiH4、 高 sp3 B 与水极性相似与水可以形成分子间氢键 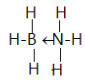 PCl4+、PCl6- PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,正四面体形阳离子中键角小于PCl3的键角; PBr5==Br-+ PBr4+ 8
PCl4+、PCl6- PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,正四面体形阳离子中键角小于PCl3的键角; PBr5==Br-+ PBr4+ 8 ![]()
【解析】试题分析:(1)由该元素的第一至五电离能数据可知,该元素第一二电离能较小,说明容易失去2个电子,即最外层有两个电子,已知该元素为第四周期的主族元素,则该元素为第四周期,第IIA族元素Ca;(2)在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象;(3)根据CO2在高温高压下所形成的晶体晶胞图,可知该晶体中原子之间通过共价键结合,为原子晶体;该晶体中C原子形成4个C-O单键,则C原子含有4价层电子对;(4) (CH3)3N中N原子提供电子对、H+提供空轨道形成配位键;(CH3)3N是极性分子,与水分子之间可以形成氢键;(5)等电子体是原子数和价电子数分别都相等的物质,A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。A是BNH6;(6) PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-;PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对; PBr5气态分子的结构与PCl5相似,它的熔体也能导电,其中只存在一种P-Br键长,则电离生成PBr4+与Br-;(7)根据晶胞图分析NaAlH4晶体中与Na+紧邻且等距的AlH4- 的个数;根据![]() 计算NaAlH4晶体的密度。
计算NaAlH4晶体的密度。
解析:(1)根据分析,该元素为Ca,M层有8个电子,M层电子排布式为3s23p6;(2)在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,组成与结构相似,相对分子量越大,分子间作用力越大,沸点越高,故a点代表的应是第IVA族的第二种元素Si的氢化物,即SiH4;(3)根据CO2在高温高压下所形成的晶体晶胞图,可知该晶体中原子之间通过共价键结合,为原子晶体,碳原子的半径比硅原子小,所以键能大,晶体的熔点比SiO2晶体高;该晶体中C原子形成4个C-O单键,则C原子含有4价层电子对,所以C原子轨道的杂化类型为sp3;(4) (CH3)3N中N原子提供电子对、H+提供空轨道形成配位键,化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,新生成的化学键为配位键,选B;(CH3)3N是极性分子,(CH3)3N与水分子之间可以形成氢键,所以(CH3)3N能溶于水;(5)等电子体是原子数和价电子数分别都相等的物质,A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。A是BNH6,结构式是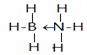 ;(6) PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-;PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,正四面体形阳离子中键角小于PCl3的键角;PBr5气态分子的结构与PCl5相似,它的熔体也能导电,其中只存在一种P-Br键长,则电离生成PBr4+与Br-,电离方程式为:PBr5=PBr4++Br -;(7)根据晶胞图,NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有8个;根据均摊原则,晶胞中含有Na+数
;(6) PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-;PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,正四面体形阳离子中键角小于PCl3的键角;PBr5气态分子的结构与PCl5相似,它的熔体也能导电,其中只存在一种P-Br键长,则电离生成PBr4+与Br-,电离方程式为:PBr5=PBr4++Br -;(7)根据晶胞图,NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有8个;根据均摊原则,晶胞中含有Na+数![]() ,晶胞中含有AlH4- 的个数是
,晶胞中含有AlH4- 的个数是![]() ,所以晶胞的摩尔质量是216g/mol,晶胞的体积是
,所以晶胞的摩尔质量是216g/mol,晶胞的体积是![]() ,
, ![]() g·cm-3 。
g·cm-3 。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案