题目内容
3.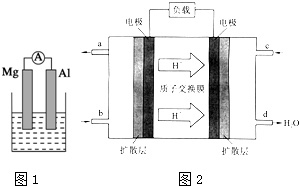 据图回答下列问题:
据图回答下列问题:Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是Mg逐渐溶解,Al片上有气泡冒出,指针偏转负极反应式为:Mg-2e-=Mg2+.
(2)若烧杯中溶液为氢氧化钠溶液,则负极为Al(填Mg或Al),总反应化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为NO3-+e-+2H+=NO2↑+H2O
Ⅲ、中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.
甲醇(CH3OH)燃料电池的工作原理如图所示.
①该电池工作时,b口通入的物质为CH3OH,c口通入的物质为O2.
②该电池正极的电极反应式为:O2+4H++4e-=2H2O.
分析 I、(1)镁比铝活泼,若烧杯中溶液为稀硫酸,镁为负极,铝为正极;
(2)铝和与氢氧化钠溶液反应,若烧杯中溶液为氢氧化钠溶液,铝为负极,镁为正极;
Ⅱ、Al遇浓硝酸发生钝化,Cu与浓硝酸发生氧化还原反应,则Cu失电子作负极,Al作正极,据此分析;
Ⅲ、①根据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料;
②负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应.
解答 解:I、(1)镁比铝活泼,若烧杯中溶液为稀硫酸,形成原电池反应,镁为负极,铝为正极,负极发生Mg-2e-=Mg2+,可观察到Mg逐渐溶解,Al片上有气泡冒出,指针偏,
故答案为:Mg逐渐溶解,Al片上有气泡冒出,指针偏转;Mg-2e-=Mg2+;
(2)铝和与氢氧化钠溶液反应,若烧杯中溶液为氢氧化钠溶液,铝为负极,镁为正极,负极生成NaAlO2,正极生成氢气,反应的总方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
Ⅱ、Al遇浓硝酸发生钝化,Cu与浓硝酸发生氧化还原反应,则Cu失电子作负极,Al作正极,正极上硝酸根离子得电子生成二氧化氮,则正极上的电极反应为NO3-+e-+2H+=NO2↑+H2O;
故答案为:NO3-+e-+2H+=NO2↑+H2O;
Ⅲ、①据氢离子移动方向知,右侧电极为正极,c口通氧气,左侧电极为负极,b口为负极上通入燃料甲醇,故答案为:CH3OH;O2;
②正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4H++4e-=2H2O,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为2CH3OH-12e-+2H2O=2CO2↑+12H+,故答案为:O2+4H++4e-=2H2O.
点评 本题综合考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握铝与氢氧化钠反应的特点,为解答该题的关键,注意相关基础知识的积累,侧重于正负极的判断和电极方程式的书写,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 丙烯分子中3个碳原子都是sp3杂化 | |
| B. | 丙烯分子存在非极性键 | |
| C. | 丙烯分子有6个σ键,1个π键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
| A. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热--检验混合物中是否含有甲醛 | |
| B. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| C. | 苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
| A. | X位于元素周期表中第2周期ⅤA族 | |
| B. | X元素有-3、+5两种化合价 | |
| C. | X元素在元素周期表中的族序数肯定为奇数 | |
| D. | X元素最高价氧化物对应的水化物可以表示为H3XO4 |
| A. | 燃烧反应都是放热反应 | |
| B. | 对于可逆反应:aA(g)+bB(g)?bC(g)+dD(g),如果正反应放热,逆反应一定吸热 | |
| C. | 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 | |
| D. | 只有放热的氧化还原反应才可以设计为原电池 |
| A. | 2CH3OH+3O2→2CO2+4H2O | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Zn+2HCl=ZnCl2+H2↑ | D. | 4Al+3O2+6H2O=4Al(OH)3 |
①2V(O2)=V(NO2)
②单位时间内生成n molO2的同时生成2n molNO2
③NO2、NO、O2的浓度之比为2:2:1
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变.
| A. | ②④⑥ | B. | ①④⑥ | C. | ②④⑤ | D. | 全部 |
| A. | X与Y形成化合物时X显负价,Y显正价 | |
| B. | 第一电离能X大于Y | |
| C. | 最高价氧化物对应的水化物的酸性:X强于Y | |
| D. | 气态氢化物的稳定性:HmX强于HmY |
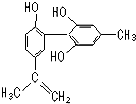 坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 该分子中的所有碳原子不可能共平面 | |
| C. | 滴入KMnO4(H+)溶液,观察紫色变浅,是因为结构中存在碳碳双键 | |
| D. | 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol |