题目内容
【题目】下列有关能量的判断和表示方法正确的是( )
A.由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ·mol-1,可知:金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,可知:含1 mol/L CH3COOH的溶液与含1mol/L NaOH的溶液混合,放出热量等于57.3 kJ
D.2gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为H2(g)+![]() O2(g) =H2O(l) ΔH=-285.8 kJ/mol
O2(g) =H2O(l) ΔH=-285.8 kJ/mol
【答案】D
【解析】
A、物质的能量越高越活泼,从C(s,石墨)═C(s,金刚石)△H=+1.9kJmol-1,金刚石能量高,可知石墨比金刚石更稳定,故A错误;
B、硫蒸气变化为固体硫放热,等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多,故B错误;
C、醋酸是弱酸,醋酸电离是吸热过程,含1molCH3COOH的溶液与含1molNaOH的溶液混合,放出热量小于57.3kJ,故C错误;
D、燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为H2(g)+![]() O2(g)═H2O(l)△H=-285.8kJmol-1,故D正确;
O2(g)═H2O(l)△H=-285.8kJmol-1,故D正确;
故选D。

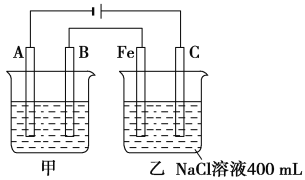
【题目】I.2017年5月5日,中国首架按照国际标准研制的拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室中研究的利用催化技术将飞机尾气中的NO和CO转变成CO2和N2的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H<0。
N2(g)+2CO2(g)△H<0。
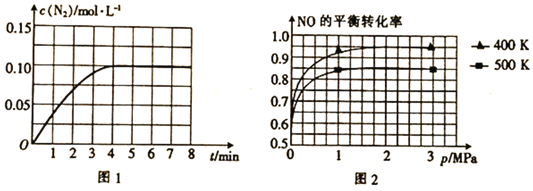
(1)若将1mol NO和2mol CO通入2L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=__________,4min末CO的浓度为__________mol·L-1。
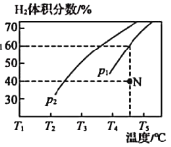
(2)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置中比较适合的温度和压强是__________
II.取50 mL0.50mol·L-1NaOH溶液和50 mL、0.50mol/L硫酸溶液进行中和热测定实验,实验数据如下表:
(1)请填写表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | __________ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 31.4 | |
(2)近似认为0.50mol·L-1 NaOH 溶液和0.50mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c =4.18J·g-1·℃-1。则中和热△H=__________。(取小数点后一位)
(3)上述实验数值结果与57.3kJ·mol-1有偏差,产生偏差的原因可能是__________(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度