题目内容
【题目】如图所示,甲、乙为相互串联的两电解池。
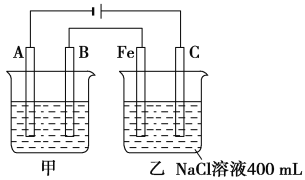
(1)甲池若为用电解原理精炼铜的装置,则A电极名称为________极,电极材料是________,电极反应式为_____________,电解质溶液可以是________。
(2)乙池中Fe极电极反应式为_________,若在乙池中滴入少量酚酞试液,开始通电一段时间,Fe极附近呈________色。
【答案】阴 精铜 Cu2++2e-=Cu 含Cu2+的溶液(如CuSO4溶液) 2H++2e-=H2↑ 红
【解析】
(1)依据电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液进行电解反应,在阴极是溶液中铜离子得到电子生成铜;
(2)乙池中Fe极为阴极,阴极阳离子放电,根据反应判断Fe附近的酸碱性。
(1)电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液(如CuSO4溶液)进行电解反应,在阴极是溶液中铜离子得到电子生成铜,电极反应是Cu2++2e═Cu;
故答案为:阴;纯铜; Cu2++2e-=Cu;含Cu2+的溶液(如CuSO4溶液);
(2)乙池C(石墨)极为电解池的阳极,Fe极为阴极,阴极阳离子放电,则Fe上氢离子得电子生成氢气,其电极反应为:2H++2e═H2↑,同时Fe电极附近还生成氢氧根离子,所以加酚酞溶液变红色;
故答案为:2H++2e═H2↑;红。

【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号 | pH | 实验现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。