题目内容
18.某化学兴趣小组探究SO2和Cl2的化学性质,他们使用的装置和药品如图所示:
(1)实验室制取SO2的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)在此实验中,e仪器的作用是防止倒吸.
(3)当A中产生足量Cl2时,观察到装置中溶液褪色的有c和ad(填装置序号).
(4)当A中产生足量SO2时,观察到装置中溶液褪色的有b和ad(填装置序号).
分析 A为气体发生装置,且在加热条件下进行,如制备二氧化硫,A中发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,二氧化硫使品红褪色,b中二氧化硫与氯化铁发生氧化还原反应,在c中与碘反应生成硫酸和HI,d为尾气处理装置;
如制备氯气,可用浓盐酸与二氧化锰反应,氯气与水反应生成具有漂白性、氧化性的次氯酸,可观察到a褪色,碘被氯气氧化为碘酸,d中氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,以此解答该题.
解答 解:(1)实验室可用亚硫酸钠和浓硫酸反应制备二氧化硫,但不需要加热,A需要加热,则用浓硫酸和铜反应,发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)由于二氧化硫易溶于水,且在检验氯气的性质时,由于氯气和氢氧化钠反应迅速,会导致装置内部气压迅速减小,导致倒吸,故答案为:防止倒吸;
(3)当A中产生足量Cl2时,氯气和水之间反应生成的次氯酸具有漂白性,能使品红退色,并且氯气可以和氢氧化钠之间反应,使得d中滴有酚酞的氢氧化钠所显示的红色消失,I2被Cl2氧化为HIO3,故答案为:ad;
(4)二氧化硫具有漂白性,能使品红褪色,具有酸性,可以和氢氧化钠发生反应生成亚硫酸钠和水,滴有酚酞的氢氧化钠溶液的红色会消失,此外还具有还原性,能和碘水之间反应得到氢碘酸和硫酸,使碘水褪色,
故答案为:ad.
点评 本题综合考查氯气、二氧化硫的性质实验设计,为高频考点和常见题型,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的原理,把握实验基本操作方法,难度不大.

| A. | 质量比和密度比均为1:1 | |
| B. | 质子数之比为7:8 | |
| C. | 二者所含原子数之比为1:2 | |
| D. | 二者完全燃烧产生二氧化碳的物质的量之比为1:2 |
| A. | 未加入稀盐酸之前:c(HCN)>c(Na+)>c( CN-)>c(OH-)>c(H+) | |
| B. | 加稀盐酸后溶液中c(CN-)+c(HCN)=c(Na+) | |
| C. | pH=7时,溶液中:c( Na+)=c( CN-) | |
| D. | 加稀盐酸后H2O的电离程度减小 |
| A. | v(A)=1mol/(L•s) | B. | v(B)=1.5mol/(L•s) | C. | v(C)=2mol/(L•s) | D. | v(D)=3mol/(L•s) |
| A. | 78% | B. | 22% | C. | 14% | D. | 13% |
| A. | 碳-12原子表示为${\;}_{6}^{12}$C | |
| B. | 氮原子的L层电子的电子排布图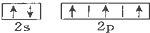 | |
| C. | 硫离子的核外电子排布式1s22s22p63s23p6 | |
| D. | NH4Cl的电子式为: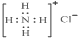 |
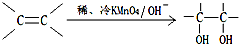 ).在下列转化关系中,P为高分子化合物.
).在下列转化关系中,P为高分子化合物.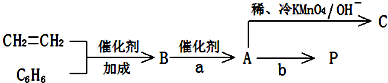
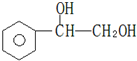 ,C与足量醋酸反应的化学方程式为
,C与足量醋酸反应的化学方程式为 ;
;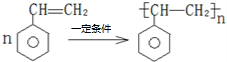 .
.