题目内容
3.质谱图显示,某化合物的相对分子质量为74,燃烧实验发现其分子内碳、氢原子个数之比为2:5,核磁共振氢谱显示,该物质中只有两种类型的氢原子.关于该化合物的描述中,不正确的是( )| A. | 该化合物可能为2甲基2丙醇 | B. | 该化合物为2丁醇的同分异构体 | ||
| C. | 该化合物可能为乙醚 | D. | 该化合物为乙醚的同系物 |
分析 该化合物中碳、氢原子个数之比为2:5,结合选项可知,该有机物中含有CH、O元素,则H原子数只能为偶数,其分子式中至少满足C4H10,由于H原子已经达到饱和,则该有机物中一定含有4个C、10个H,含有氧原子数目为:$\frac{74-12×4-1×10}{16}$=1,所以该有机物分子式为:C4H10O,再结合该物质中含有两种类型的氢原子对各选项进行判断.
解答 解:该化合物中碳、氢原子个数之比为2:5,结合选项可知,该有机物中含有CH、O元素,则H原子数只能为偶数,其分子式中至少满足C4H10,由于H原子已经达到饱和,则该有机物中一定含有4个C、10个H,含有氧原子数目为:$\frac{74-12×4-1×10}{16}$=1,所以该有机物分子式为:C4H10O,
A.该物质中氢原子只有两种类型,2-甲基-2-丙醇(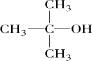 )符合题目要求,故A正确;
)符合题目要求,故A正确;
B. 为2-丁醇的同分异构体,根据A可知符合题目要求,故B正确;
为2-丁醇的同分异构体,根据A可知符合题目要求,故B正确;
C.乙醚的结构简式为:CH3-CH2-O-CH2-CH3,其分子中含有2种等效H、分子式为C4H10O,符合题中要求,故C正确;
D.分子式为C4H10O醚类物质,分子中含有2种等效H,满足条件的只能为乙醚,不可能为乙醚的同分异构体,故D错误;
故选D.
点评 本题考查了有机物结构式的确定、同系物、同分异构体的应用,题目难度中等,正确推断该化合物分子式为解答关键,注意明确核磁共振氢谱中吸收峰的含义.

练习册系列答案
相关题目
13.下列关于氧化还原反应中电子转移数目的判断不正确的是( )
| A. | 5.6g铁粉与氯气充分反应失去的电子数一定为0.3NA | |
| B. | 0.1mol Zn与含0.1mol HCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeCl2溶液中通入Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
11.已知:H+H→H2 过程放出437.6kJ热量,下列说法正确的是( )
| A. | 氢气分子内每个氢原子都达到8电子稳定结构 | |
| B. | 相同条件下1mol H2的能量比2mol H的能量低 | |
| C. | 1mol H2离解成2mol H要放出437.6kJ热量 | |
| D. | 氢原子比氢分子性质更稳定 |
18.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 碳酸钙高温下分解 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
15.分子式为C5H11Cl结构中含2个-CH3的同分异构体有( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
12.已知NH4CuSO3与足量的10mol/L硫酸混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.据此判断下列说法正确的是( )
| A. | 刺激性气味的气体是氨气 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 1 mol NH4CuSO3完全反应转移0.5 mol电子 | |
| D. | 反应中硫酸作氧化剂 |
13.室温下将等物质的量的NaCN和HCN溶于一定量水中,再加入适量稀盐酸,调整溶液pH=7.下列说法正确的是( )
| A. | 未加入稀盐酸之前:c(HCN)>c(Na+)>c( CN-)>c(OH-)>c(H+) | |
| B. | 加稀盐酸后溶液中c(CN-)+c(HCN)=c(Na+) | |
| C. | pH=7时,溶液中:c( Na+)=c( CN-) | |
| D. | 加稀盐酸后H2O的电离程度减小 |
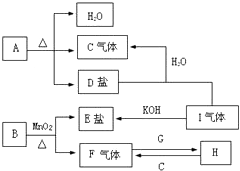 已知A、B、C、D、E、F、G、H、I九种物质,A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G是一种单质,I是一种化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答下列问题:
已知A、B、C、D、E、F、G、H、I九种物质,A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G是一种单质,I是一种化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答下列问题: