题目内容
(15分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
① ② ③ ④ ⑤
称取粗盐

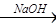
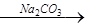
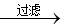 滤液
滤液
⑥ ⑦

 精盐
精盐
(1)判断BaCl2已过量的方法是
(2)第④步中,相关的离子方程式是
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
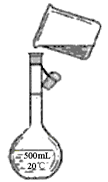
(4)为检验精盐纯度,特配制150 mL 0.2 mol·L—1 NaCl溶液,下图是该同学转移溶液的示意图,图中的错误是
(5)提纯过程中步骤①⑤⑦都用到相同的仪器,名称:
这三个步骤中还需要用到的属于硅酸盐材料的仪器有 (填写仪器名称)
① ② ③ ④ ⑤
称取粗盐


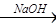
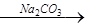
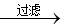 滤液
滤液⑥ ⑦

 精盐
精盐(1)判断BaCl2已过量的方法是
(2)第④步中,相关的离子方程式是
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
(4)为检验精盐纯度,特配制150 mL 0.2 mol·L—1 NaCl溶液,下图是该同学转移溶液的示意图,图中的错误是

(5)提纯过程中步骤①⑤⑦都用到相同的仪器,名称:
这三个步骤中还需要用到的属于硅酸盐材料的仪器有 (填写仪器名称)
(1)静置,往上层清液中滴加氯化钡溶液,不产生沉淀(静置,取上层清液,滴加碳酸钠溶液,产生沉淀)( 2分) (2)Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓( 2分)
(3)杂质重新溶解( 2分) (4)没有用玻璃棒引流、容量瓶规格不对(各 2分)
(5)玻璃棒 烧杯 漏斗 蒸发皿 酒精灯( 5分)
(3)杂质重新溶解( 2分) (4)没有用玻璃棒引流、容量瓶规格不对(各 2分)
(5)玻璃棒 烧杯 漏斗 蒸发皿 酒精灯( 5分)
(1)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(2)碳酸钠可以将钙离子以及过量的钡离子沉淀下来,反应原理是Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓,故答案为:Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓;
(3)若先用盐酸调pH再过滤,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,将对实验结果产生影响,故答案为:在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度;(4)向容量瓶中转移液体时,要用玻璃棒来引流,配制一定体积的溶液要选择一定体积的容量瓶,故答案为:未用玻璃棒引流,容量瓶规格不对.
(2)碳酸钠可以将钙离子以及过量的钡离子沉淀下来,反应原理是Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓,故答案为:Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓;
(3)若先用盐酸调pH再过滤,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,将对实验结果产生影响,故答案为:在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度;(4)向容量瓶中转移液体时,要用玻璃棒来引流,配制一定体积的溶液要选择一定体积的容量瓶,故答案为:未用玻璃棒引流,容量瓶规格不对.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
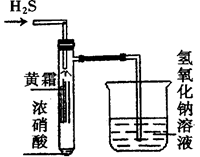

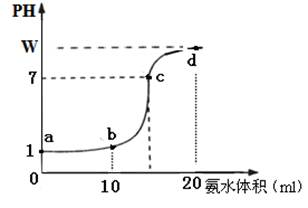

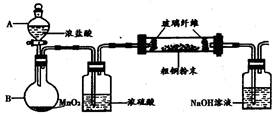
 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)