题目内容
(18分)某学生欲用已知物质的量浓度的氨水来测定未知物质的量浓度的盐酸溶液,请填写下列空白:
Ⅰ.(1)(6分)用标准的氨水溶液滴定盐酸溶液时,锥形瓶中应加入 作指示剂, ___ ____手摇动锥形瓶,眼睛注视 ,滴定终点现象为:
(2)下列操作中可能使所测盐酸溶液的浓度数值偏低的是___ (2分)
A.酸式滴定管未用盐酸溶液润洗就直接注入盐酸溶液
B.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.读取氨水体积时,滴定开始时仰视读数,滴定结束时俯视读数
E. 滴定时标准液滴出锥形瓶外
Ⅱ. (10分)常温下,用0.2 mol·L-1氨水溶液滴定20ml盐酸溶液,随氨水滴加溶液PH变化如图所示,据图回答下列问题:
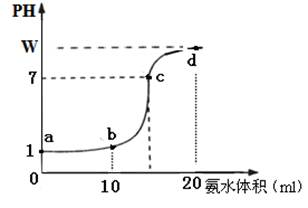
(1)该盐酸溶液的物质的量浓度为 。
(2)在c点溶液中所有离子浓度由大到小的顺序为:
(3)若正确加入指示剂,滴定终点位于曲线
A.d点 B.c点 C.a、c之间 D.d点之后
(4)a、b、c三点处溶液中,水电离出的氢离子浓度由大到小顺序为 。
(用a、b、c表示)
(5)写出d点溶液中c(NH3·H2O)的精确表达式
mol·L-1 (混合溶液总体积等于两溶液体积之和)
Ⅰ.(1)(6分)用标准的氨水溶液滴定盐酸溶液时,锥形瓶中应加入 作指示剂, ___ ____手摇动锥形瓶,眼睛注视 ,滴定终点现象为:
(2)下列操作中可能使所测盐酸溶液的浓度数值偏低的是___ (2分)
A.酸式滴定管未用盐酸溶液润洗就直接注入盐酸溶液
B.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.读取氨水体积时,滴定开始时仰视读数,滴定结束时俯视读数
E. 滴定时标准液滴出锥形瓶外
Ⅱ. (10分)常温下,用0.2 mol·L-1氨水溶液滴定20ml盐酸溶液,随氨水滴加溶液PH变化如图所示,据图回答下列问题:

(1)该盐酸溶液的物质的量浓度为 。
(2)在c点溶液中所有离子浓度由大到小的顺序为:
(3)若正确加入指示剂,滴定终点位于曲线
A.d点 B.c点 C.a、c之间 D.d点之后
(4)a、b、c三点处溶液中,水电离出的氢离子浓度由大到小顺序为 。
(用a、b、c表示)
(5)写出d点溶液中c(NH3·H2O)的精确表达式
mol·L-1 (混合溶液总体积等于两溶液体积之和)
(18分)
Ⅰ.(1)(6分)甲基橙 , ____右____ 溶液滴速和和锥形瓶中溶液颜色变化 ,滴定终点现象为: 锥形瓶中溶液颜色由红色变为橙色,且半分钟内不再变色。
(2)__A__D_(2分)
Ⅱ. (10分)(1)0.1mol/l (2)c(Cl-)= c(NH4+)>c(H+)=c(OH-)
(3) C (4) bca (5) 0.05+10-W-10W-14 mol·L-1
Ⅰ.(1)(6分)甲基橙 , ____右____ 溶液滴速和和锥形瓶中溶液颜色变化 ,滴定终点现象为: 锥形瓶中溶液颜色由红色变为橙色,且半分钟内不再变色。
(2)__A__D_(2分)
Ⅱ. (10分)(1)0.1mol/l (2)c(Cl-)= c(NH4+)>c(H+)=c(OH-)
(3) C (4) bca (5) 0.05+10-W-10W-14 mol·L-1
本题考查酸碱中和滴定和弱电解质电离的相关问题。Ⅰ、氨水滴定盐酸,终点生成强酸弱碱盐,水解呈酸性,故使用甲基橙做指示剂(3.1~4.4),终点现象为红色变为橙色,且半分钟不褪色;误差分析根据c(HCl)= A、未润洗,导致HCl的稀释,浓度减小;B、锥形瓶未干燥,不影响;C、碱式滴定管先有气泡,后没有,是V(NH3·H2O)增大,c(HCl)偏大;D、先仰视、后俯视,使V(NH3·H2O)减小,c(HCl)偏小;E、有标准液洒出,使V(NH3·H2O)增大,c(HCl)偏大;故答案为AD。
Ⅱ、(1)看起点pH=1,说明c(H+)=0.1mol/L,故c(HCl)= 0.1mol/L;(2)c点pH=7,呈中性c(H+)=c(OH-),根据电荷守恒c(NH)=c(Cl-);有c(NH)=c(Cl-)> c(H+)=c(OH-);(3)滴定终点,恰好反应生成NH4Cl,水解呈酸性,终点在b、c之间,答案为C;(4)a点,pH=1,水电离的c(H+)=10-13mol/L、b点HCl恰好中和,NH4Cl水解,水电离的c(H+)>10-7mol/L;c点呈中性,c(H+)=10-7mol/L,水电离的氢离子浓度由大到小为:b、c、a;(5)电荷守恒有:c(NH)+ c(H+)=c(Cl-)+c(OH-),c(NH)=c(Cl-)+c(OH-)- c(H+)=+10W-14-10-W,又由物料守恒有n(NH3·H2O)+ n(NH)="0.02" mol/L×0.02L,
c(NH3·H2O)==0.05+10-W-10W-14 mol·L-1
Ⅱ、(1)看起点pH=1,说明c(H+)=0.1mol/L,故c(HCl)= 0.1mol/L;(2)c点pH=7,呈中性c(H+)=c(OH-),根据电荷守恒c(NH)=c(Cl-);有c(NH)=c(Cl-)> c(H+)=c(OH-);(3)滴定终点,恰好反应生成NH4Cl,水解呈酸性,终点在b、c之间,答案为C;(4)a点,pH=1,水电离的c(H+)=10-13mol/L、b点HCl恰好中和,NH4Cl水解,水电离的c(H+)>10-7mol/L;c点呈中性,c(H+)=10-7mol/L,水电离的氢离子浓度由大到小为:b、c、a;(5)电荷守恒有:c(NH)+ c(H+)=c(Cl-)+c(OH-),c(NH)=c(Cl-)+c(OH-)- c(H+)=+10W-14-10-W,又由物料守恒有n(NH3·H2O)+ n(NH)="0.02" mol/L×0.02L,
c(NH3·H2O)==0.05+10-W-10W-14 mol·L-1

练习册系列答案
相关题目

 始沉淀时的pH
始沉淀时的pH 。(填序号)
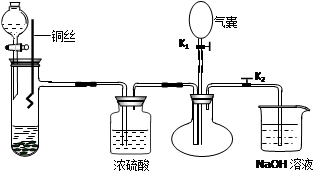
。(填序号) ++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)
++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)


 滤液
滤液
 精盐
精盐