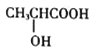题目内容
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)元素p为26号元素,请写出其原子的三价阳离子的电子排布式:______________。
(2)e与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)请写出f的氢化物在水中所存在氢键的表达式:(任写两种即可)_________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________;
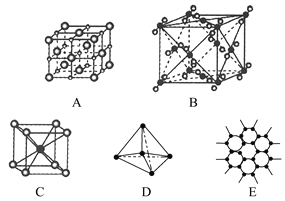
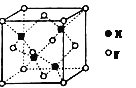
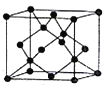
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
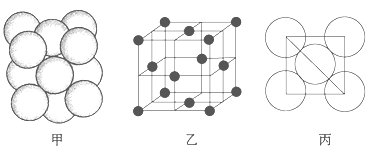
请问晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
【答案】 1s22s22p63s23p63d5 sp3 极性 ![]()
![]()
![]()
![]() (任写两种) Mn2+的3d轨道电子排布为半满状态,较稳定 12 4
(任写两种) Mn2+的3d轨道电子排布为半满状态,较稳定 12 4
【解析】 (1)元素p为26号元素,为Fe元素,其原子的三价阳离子Fe3+的的电子排布式为1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5;
(2) 根据元素在周期表中的位置可知,a为H元素,e为O元素,e与a反应的产物为水,中心原子O的价层电子对数目=2+![]() ×(6-1×2)4,杂化形式为sp3杂化,空间构型为V形,分子中正负电荷发布不均匀,该分子是极性分子,故答案为:sp3;极性;
×(6-1×2)4,杂化形式为sp3杂化,空间构型为V形,分子中正负电荷发布不均匀,该分子是极性分子,故答案为:sp3;极性;
(3) 根据元素在周期表中的位置可知,f为F元素,HF在水中所存在氢键的表达式为![]()
![]()
![]()
![]() ,故答案为:
,故答案为: ![]()
![]()
![]()
![]() ;
;
(4) o为Mn元素,p为Fe元素, Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态,所以气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,故答案为:Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态;
(5)根据图片知,Al单质为面心立方最密堆积,Al原子配位数配位数=3×![]() ×8=12,由图2可知占据顶点和面心,则个数为8×
×8=12,由图2可知占据顶点和面心,则个数为8×![]() +6×
+6×![]() =4,故答案为:12;4。
=4,故答案为:12;4。

 阅读快车系列答案
阅读快车系列答案