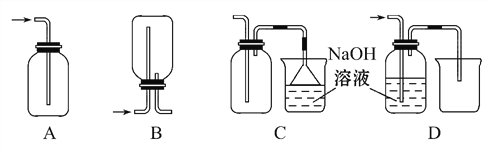
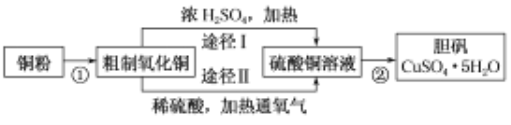
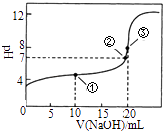
题目内容
【题目】氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-![]() NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_____________________。
(2)反应中硝酸体现了_____、_____性质。
(3)若反应中转移的电子总数为0.15 NA(NA是阿伏加德罗常数的值),则产生的NO在标准状况下的体积是_____ L。
【答案】 14HNO3+3Cu2O![]() 6Cu(NO3)2+2NO↑+7H2O 酸性 氧化性 1.12
6Cu(NO3)2+2NO↑+7H2O 酸性 氧化性 1.12
【解析】(1)硝酸具有氧化性,题目提供的四种物质中只有Cu2O 具有还原性,所以反应的方程式为硝酸与Cu2O反应生成硝酸铜、NO与水,反应方程式为: 14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O
(2)反应中硝酸中氮元素存在硝酸铜、NO中,硝酸铜中氮元素化合价不变,硝酸表现酸性,NO中氮元素化合价降低,硝酸表现氧化性;因此,本题正确答案是:酸性、氧化性,
(3)反应中只有N元素的化合价降低,由+5价降低为+2价,生成的NO的物质的量为0.15mol/(5-2)=0.05mol,V(NO)=0.05mol×22.4L/mol=1.12L,因此,本题正确答案是:1.12。

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目