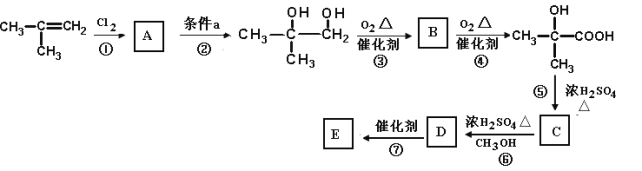
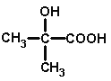
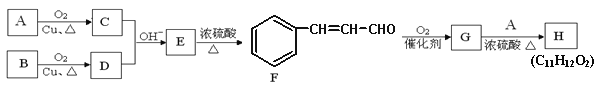
��Ŀ����
����Ŀ��ij��ѧ��ȤС��ⶨ��������Ҫ�ɷ�FeS2����������Ԫ�ص�������������������ʵ�飺��m1g��Ʒ������ͼ��ʾװ��C�У���K1�ر�K2����a������ͨ���������������ʯӢ���е���Ʒ��
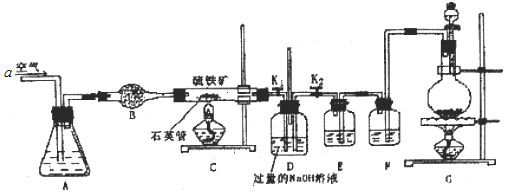
��ش��������⣺
��1��װ��B������Ϊ_____��a������ͨ�������Ŀ����_____��
��2��װ��A��������_____��
��3����Ӧ�����ر�K1��K2������ƿ�м���Һ�壬��ȼG���ƾ��ƣ�ʹ��ƿ�з�Ӧ����������������ͼ��
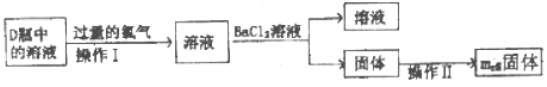
�ٲ���I������Һ��������������_____��
�ڲ�������ϴ�ӡ���ɡ����أ���������Ƿ�ϴ���ķ�����_____��
�۸�����������Ԫ�ص���������Ϊ_____���ú�m1��m2�Ĵ���ʽ��ʾ��
��4��ȡ���պ������������Fe2O3��FeO��������֤���д���FeO��Ӧѡ�õ��Լ���_____��
���𰸡����θ���� �ṩ����ʹ��������ȼ�գ�ͬʱʹ�������ɵĶ�������������ȫ��D������������Һ���� ����ͨ���������ʹ֮ƽ�� Na2SO4��NaCl��NaClO ȡ���һ��ϴ��Һ�������Թ��е������������ữ����������Һ�����ޱ�ʯ�������������Ѿ�ϴ�� ![]() ��100% ϡ���ᡢ���������Һ
��100% ϡ���ᡢ���������Һ
��������
��1�����������Ľṹ��֪��װ��B������Ϊ���θ���ܣ�a������ͨ�������Ŀ�����ṩ����ʹ��������ȼ�գ�ͬʱʹ�������ɵĶ�������������ȫ��D������������Һ���գ�
��2��װ��A�������ǿ���ͨ���������ʹ֮ƽ�ȣ�
��3����D�ж����������������������Һ��Ӧ��������������Һ��Dƿ��Ϊ�������ƺ��������ƵĻ����Һ��ͨ���������������������������������������������ƺ����ᣬ�������������Ʒ�Ӧ�����Ȼ��ƺ�ˮ�������������������Ʒ�Ӧ�����Ȼ��ƺʹ������ƣ��ʲ���I������Һ��������������Na2SO4��NaCl��NaClO��
�ڲ�������ϴ�ӡ���ɡ����أ���������Ƿ�ϴ���ķ�����ȡ���һ��ϴ��Һ�������Թ��е������������ữ����������Һ�����ޱ�ʯ�������������Ѿ�ϴ����
�۲������õ�m2g����Ϊ���ᱵ������������ԭ���غ㣬������������Ԫ�ص�����Ϊ![]() g��������������Ԫ�ص���������Ϊ
g��������������Ԫ�ص���������Ϊ![]() ��100%��
��100%��
��4��ȡ���պ������������Fe2O3��FeO��������֤���д���FeO������+3����������¼���+2����Ӧ����+2�����Ļ�ԭ�Խ��м��飬��ѡ�õ��Լ���ϡ���ᡢ���������Һ��

 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�����Ŀ����������ʵ��������������ó��Ľ�����ȷ����
ѡ�� | ʵ����������� | ���� |
A | �������м���Ũ���ᣬ����ú�ɫ����״���壬���ų��̼�����ζ���� | Ũ�����������ˮ�Ժ���ˮ�� |
B | ����ɫʯ����ֽ�ϵμ�������ˮ����ֽ��Ե�ʺ�ɫ���м�Ϊ��ɫ | ��ˮ�����������л�ԭ�� |
C | ±����Y��NaOH��Һ���Ⱥ�������ϡ���ᣬ�ٵμ�AgNO3��Һ��������ɫ���� | ±����Y�к�����ԭ�� |
D | ȡ5 mL 0.1 mol��L��1KI��Һ������1 mL 0.1 mol��L��1FeCl3��Һ����ȡ��Һ����ˮ�����KSCN��Һ����Һ���Ѫ��ɫ | Fe3����I���������ķ�ӦΪ���淴Ӧ |
A. A B. B C. C D. D