题目内容
【题目】锌锰电池(俗称干电池)在生活中的用量很大。其中普通锌锰电池的构造图如右图所示。回答下列问题:
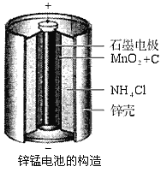
(1)电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,正极发生的主要反应是________________________。
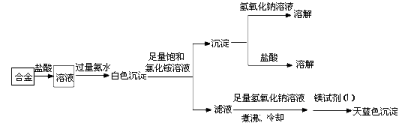
(2)下图表示从废旧普通锌锰电池除去锌壳和电极后的内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。

①黑色固体混合物水浸时为提高浸出速率,常采用的措施为________________(答两条);得到滤液加入稀盐酸的作用为__________________。
②滤渣水洗灼烧后固体主要成份只有一种,操作a中得到熔块的主要成分是K2MnO4,该过程中发生反应的化学方程式为:_____________________________。
③图中产物的化学式分别为:A__________、B_________。
(3)准确称量得到的KMnO4(不含能与草酸反应的杂质)3.160 g,放入小烧杯中,加水溶解后转移到200mL容量瓶中定容,在锥形瓶中用差量法称取0.6700 g无水草酸钠,加入足量硫酸溶液溶解,加热至75~80℃。用已配制好的KMnO4溶液进行滴定,消耗溶液体积为22.50mL。
已知Mr(Na2C2O4)=134 Mr(KMnO4)=158
①判断滴定终点的现象是__________________。
②KMnO4的纯度为__________。
【答案】(1)MnO2+NH4++e-=MnOOH+NH3;
(2)①加热、将固体混合物粉碎、搅拌;Zn(NH3)2Cl2+2HCl=ZnCl2+2NH4Cl,并抑制浓缩时发生水解;
②3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O;③MnO2,NH4Cl;
3K2MnO4+KCl+3H2O;③MnO2,NH4Cl;
(3)①当滴入最后一滴溶液,溶液变为浅红色且半分钟内不褪色;②88.89%。
【解析】
试题分析:(1)(1)正极反应是化合价降低,得到电子,MnO2中Mn化合价有+4价→+3价,根据总电极反应式,正极反应式:MnO2 +NH4+ + e- = MnOOH + NH3;(2)①提高进出速率,就是提高反应速率,可以升高温度、将固体粉碎、搅拌,加入盐酸的目的是Zn(NH3)2Cl2转化成ZnCl2和NH4Cl,ZnCl2和NH4Cl的溶液显酸性,加盐酸能够抑制它们的水解,发生的反应方程式为:Zn(NH3)2Cl2 + 2HCl = ZnCl2 + 2NH4Cl;②加水浸取后的滤渣是MnOOH,水洗灼烧的得到MnO2,操作a中Mn的化合价有+4价→+6价,作还原剂,KClO3作氧化剂,Cl由+5价→-1价,根据化合价升降法进行配平,得到:3MnO2 + KClO3 + 6KOH ![]() 3K2MnO4 +KCl+3H2O;③熔块中 K2MnO4→KMnO4,Mn的化合价升高,需要有化合价降低,因此K2MnO4中Mn的化合价转化为MnO2,发生的反应是3K2MnO4+4CO2+2H2O=2KMnO4+MnO2+4KHCO3,过滤,得到滤渣为MnO2,根据②的分析,NH4Cl不稳定受热易分解,遇冷重新生成NH4Cl,因此化合物B为NH4Cl,化合物C为ZnCl2;(3)利用高锰酸钾的强氧化性把草酸氧化,因此滴定终点的现象是:当滴入最后一滴溶液,溶液变为浅红色且半分钟内不褪色;②根据得失电子数目守恒,n(KMnO4)×(7-2)=n(Na2C2O4)×2×(4-3),n(KMnO4)=0.67×2/(134×5)mol=2×10-3mol,高锰酸钾的质量分数为2×10-3×158×200/(22.50×3.160)×100%=88.89%。
3K2MnO4 +KCl+3H2O;③熔块中 K2MnO4→KMnO4,Mn的化合价升高,需要有化合价降低,因此K2MnO4中Mn的化合价转化为MnO2,发生的反应是3K2MnO4+4CO2+2H2O=2KMnO4+MnO2+4KHCO3,过滤,得到滤渣为MnO2,根据②的分析,NH4Cl不稳定受热易分解,遇冷重新生成NH4Cl,因此化合物B为NH4Cl,化合物C为ZnCl2;(3)利用高锰酸钾的强氧化性把草酸氧化,因此滴定终点的现象是:当滴入最后一滴溶液,溶液变为浅红色且半分钟内不褪色;②根据得失电子数目守恒,n(KMnO4)×(7-2)=n(Na2C2O4)×2×(4-3),n(KMnO4)=0.67×2/(134×5)mol=2×10-3mol,高锰酸钾的质量分数为2×10-3×158×200/(22.50×3.160)×100%=88.89%。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案