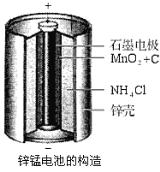
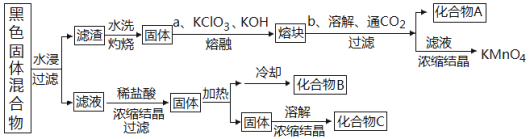
题目内容
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1mol羟基与1mol氢氧根离子所含的电子数均为9NA
B.常温下,44g N2O和CO2组成的混合气体,所含原子数为3NA
C.0.1mol/L的NaClO溶液,含有的阴离子数为0.1NA
D.常温下,将1molFe投入过量浓硝酸中,转移的电子数为3NA
【答案】B
【解析】
试题分析:A.1mol羟基含有9mol电子,1mol氢氧根离子含有10mol电子,故A错误;B.常温下,44g N2O和CO2组成的混合气体的物质的量为![]() =1mol,所含原子数为3NA,故B正确;C.未注明溶液的体积,无法计算0.1mol/L的NaClO溶液中含有的阴离子数,故C错误;D.常温下,Fe与浓硝酸发生钝化,故D错误;故选B。
=1mol,所含原子数为3NA,故B正确;C.未注明溶液的体积,无法计算0.1mol/L的NaClO溶液中含有的阴离子数,故C错误;D.常温下,Fe与浓硝酸发生钝化,故D错误;故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】A~H均为短周期元素,A~F在元素周期表中的相对位置如下图所示,G与其它七种元素不在同一周期,H是短周期中原子半径最大的主族元素。由B、G组成的气态化合物甲水溶液呈碱性。
A | B | C | |
D | E | F |
请回答下列问题:
(1)写出甲的电子式,实验室制取气体甲的化学方程式为。
(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为。
A.离子键
B.极性键
C.非极性键
(3)请用电子式表示AE2的形成过程。
(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序。
(5)用一个离子方程式解释A比D非金属性强的原因。