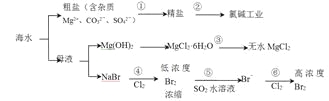
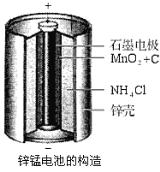
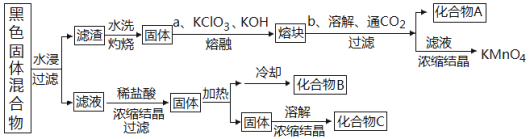
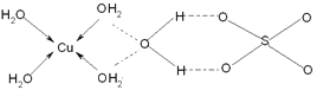
题目内容
【题目】(1)某Al2(SO4)3溶液V mL中含有Al3+a g,取出V/4 mL溶液稀释成V mL后,SO42― 离子的物质的量浓度为 (用含a、V的代数式表示,化简到最简整数比)
(2)标准状况下,密度为0.75 g/L的C2H4与CH4组成的混合气体中,C2H4的体积分数约为 。(保留三位有效数字)
(3)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.3 L水中,所得溶液密度为ρ g/mL,则此溶液物质的量浓度为 。(用含ρ、V 、M的代数式表示,化简到最简整数比)
(4)一定温度下,将a molSO3气体通入体积为V L的密闭容器中发生如下反应:2SO3=2SO2+O2,一段时间之后测得生成氧气的物质的量为b mol(2b<a),则这段时间内,反应前后气体的压强比为 ,反应前后气体的密度比为 ,反应后气体的平均相对分子质量为 。(化简到最简整数比)
【答案】
(1)![]() mol/L;
mol/L;
(2)6.67%或0.0667;
(3)1000ρV /(VM +6720 )mol/L;
(4)a/(a+b);1:1;80a/(a+b);
【解析】
试题分析:(1)agAl3+的物质的量=![]() =
=![]() mol,溶液中n(Al3+):n(SO42-)=2:3,VL溶液中n(SO42-)=
mol,溶液中n(Al3+):n(SO42-)=2:3,VL溶液中n(SO42-)=![]() mol×
mol×![]() =
=![]() mol,故
mol,故![]() mL溶液中n(SO42-)=
mL溶液中n(SO42-)=![]() mol×
mol×![]() =
=![]() mol,故稀释后溶液中SO42-物质的量浓度为
mol,故稀释后溶液中SO42-物质的量浓度为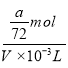 =
=![]() mol/L=
mol/L=![]() mol/L,故答案为:
mol/L,故答案为:![]() mol/L;
mol/L;
(2)标准状况下,密度为0.75 g/L的C2H4与CH4组成的混合气体的平均摩尔质量为中0.75 g/L×22.4L=16.8g/mol,根据十字交叉法,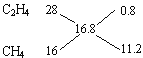 ,C2H4和CH4的物质的量之比为
,C2H4和CH4的物质的量之比为![]() =
=![]() ,因此C2H4的体积分数=
,因此C2H4的体积分数=![]() ×100%=6.67%,故答案为:6.67%;
×100%=6.67%,故答案为:6.67%;
(3)标况下,VL气体的物质的量=![]() =
=![]() mol,气体的质量为
mol,气体的质量为![]() mol×Mg/mol=
mol×Mg/mol=![]() g,水的质量为300mL×1g/mL=300g,溶液的质量为(300+
g,水的质量为300mL×1g/mL=300g,溶液的质量为(300+![]() )g,溶液的体积为(300+
)g,溶液的体积为(300+![]() )g÷1000ρ g/L=
)g÷1000ρ g/L=![]() L,故该溶液的物质的量浓度为
L,故该溶液的物质的量浓度为![]() mol÷
mol÷![]() L=
L=![]() mol/L,故答案为:
mol/L,故答案为:![]() mol/L;
mol/L;
(4)根据2SO3=2SO2+O2,可知生成氧气的物质的量为b mol,同时生成2b mol SO2,反应2b mol SO3,同温同体积条件下,气体的压强之比等于物质的量之比,反应前后气体的压强比为![]() =
=![]() ;气体的质量不变,容器的体积不变,气体的密度不变,反应前后气体的密度比为1:1;反应后气体的平均相摩尔质量为
;气体的质量不变,容器的体积不变,气体的密度不变,反应前后气体的密度比为1:1;反应后气体的平均相摩尔质量为![]() =
=![]() g/mol,反应后气体的平均相摩尔质量为
g/mol,反应后气体的平均相摩尔质量为![]() ,故答案为:
,故答案为:![]() ;1:1;
;1:1;![]() 。
。

 阅读快车系列答案
阅读快车系列答案