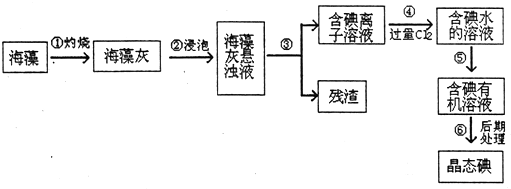
题目内容
17.下列说法正确的是( )| A. | 现代元素周期表中,元素按照元素的相对原子质量递增顺序排列 | |
| B. | 最外层电子数相同的不同元素一定处于同-主族 | |
| C. | 在元素周期表中金属与非金属的分界线附近,可以找到半导体材料 | |
| D. | X2+的核外电子数目为18,则X处于笫三周期第ⅡA族 |
分析 A.现代元素周期表中,同一横行按核电荷数增大顺序由左而由排列,同一纵行自上而下按电子层递增顺序排列;
B.最外层电子数相同的不同元素不一定处于同一主族,如He、Mg、Zn等;
C.具有一定的金属性与非金属性的元素可以作半导体材料;
D.X2+的核外电子数目为18,则X的质子数为20,处于第四周期第ⅡA族.
解答 解:A.现代元素周期表中,同一横行按核电荷数增大顺序由左而由排列,同一纵行自上而下按电子层递增顺序排列,故A错误;
B.同一主族元素最外层电子数相同,但最外层电子数相同的不同元素不一定处于同一主族,如He、Mg、Zn等,故B错误;
C.在元素周期表中金属与非金属的分界线附近的元素具有一定的金属性与非金属性,可以找到半导体材料,故C正确;
D.X2+的核外电子数目为18,则X的质子数为20,处于第四周期第ⅡA族,故D错误,
故选C.
点评 本题考查元素周期表,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
7.物质的量相同的碳酸钠和碳酸氢钠分别跟过量盐酸反应,下列说法正确的是( )
| A. | 碳酸钠放出CO2多 | B. | 碳酸氢钠放出CO2多 | ||
| C. | 碳酸钠消耗盐酸多 | D. | 碳酸氢钠消耗盐酸多 |
8.两种钠盐混合、分装于两只试管中.其中一支加热产生CO2气体,另一支加水也产生CO2气体.这两种盐可能是( )
| A. | Na2CO3和NaHSO4 | B. | Na2CO3和NaHCO3 | C. | NaHCO3和NaHSO4 | D. | NaHCO3和Na2SO4 |
2.硫酸钙可用生产疏酸、漂白粉等一系列物质.下列说法正确的是( )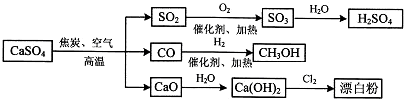

| A. | 由CO与H2合成CH3CH2OHO的反应中,原子利用率为100% | |
| B. | 向蔗糖中加入浓硫酸,蔗糖变黑同时产生刺激性气味的气体,说明浓硫酸具有脱水性和强氧化性 | |
| C. | 二氧化硫和漂白粉都能使品红溶液褪色,两者漂白性质相同 | |
| D. | 图中所有反应均为氧化还原反应 |
9.下列文字表述与反应方程式对应且正确的是( )
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 溴乙烷与KOH溶液反应:CH3CH2Br+H2O$→_{△}^{KOH}$C2H5OH+HBr | |
| C. | 甲苯与浓硝酸和浓硫酸的混合物反应: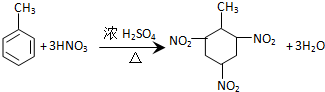 | |
| D. | 实验室用溴水和苯制溴苯: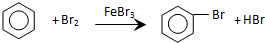 |
6.下列有关说法不正确的是( )
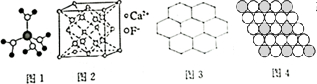

| A. | 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 | |
| B. | CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+ | |
| C. | 石墨的片层结构如图3所示,在片层结构中,碳原子数、C-C键数、六元环数之比为2:3:2 | |
| D. | 某晶体二维平面模型如图4所示,则其化学式可表示为AB2 |
7.将一定量Na2O2和NaHCO3混合后,在密闭容器中加热充分反映,排除气体,冷却后有固体物质剩余,下列选项不正确的是( )
| Na2O2/mol | NaHCO3/mol | 气体成分 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2 Na2CO3 |
| C | 2 | 1 | Na2CO3、NaOH、Na2O2 |
| D | 3 | 2 | NaOH、Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
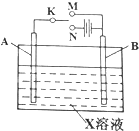 利用如图装置,可以进行许多电化学实验.
利用如图装置,可以进行许多电化学实验.