题目内容
6.下列有关说法不正确的是( )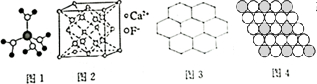
| A. | 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 | |
| B. | CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+ | |
| C. | 石墨的片层结构如图3所示,在片层结构中,碳原子数、C-C键数、六元环数之比为2:3:2 | |
| D. | 某晶体二维平面模型如图4所示,则其化学式可表示为AB2 |
分析 A.水合铜离子中铜离子的配位数为4,配体是水,水中的氧原子提供孤电子对与铜离子形成配位键;
B.根据均摊法可知,在CaF2晶体的晶胞中,每个CaF2晶胞平均占有Ca2+个数为$\frac{1}{4}$=4;
C.根据均摊法计算碳环数和碳碳键数目;
D.由图中直接相邻的原子数可以求出AB中两类原子数目之比.
解答 解:A.水合铜离子中铜离子的配位数为4,配体是水,水中的氧原子提供孤电子对与铜离子形成配位键,故A正确;
B.根据均摊法可知,在CaF2晶体的晶胞中,每个CaF2晶胞平均占有Ca2+个数为$\frac{1}{8}$=4,故B正确;
C.每个碳原子为3个环共用,一个正六边形含有碳原子个数=6×$\frac{1}{3}$=2,则每个碳原子可形成$\frac{1}{2}$个环,每个碳被3个键共用,则每个碳原子可形成$\frac{3}{2}$键,在片层结构中,碳原子数、C-C键数、六元环数之比为2:$\frac{3}{2}$×2:$\frac{1}{2}$×2=2:3:1,故C错误;
D.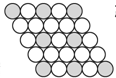 图中每个黑球周围有6个白色球,而每个白色球为2个黑球共有,故黑球与白色球数目之比=1:6×$\frac{1}{2}$=1:3,化学式为AB3,故D错误;
图中每个黑球周围有6个白色球,而每个白色球为2个黑球共有,故黑球与白色球数目之比=1:6×$\frac{1}{2}$=1:3,化学式为AB3,故D错误;
故选CD.
点评 本题考查了配合物、离子晶体、根据晶体图来确定化学式等知识,题目难度中等,解题关键是对图要仔细观察,同时正确理解基本概念.

练习册系列答案
相关题目
16.下列物质的系统命名中,错误的是( )
| A. | 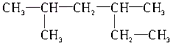 2,4-二甲基己烷 | |
| B. | 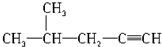 2-甲基-4-戊炔 | |
| C. | 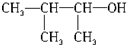 3-甲基-2-丁醇 | |
| D. | CH3-CHBr-CHBr-CH3 2,3-二溴丁烷 |
17.下列说法正确的是( )
| A. | 现代元素周期表中,元素按照元素的相对原子质量递增顺序排列 | |
| B. | 最外层电子数相同的不同元素一定处于同-主族 | |
| C. | 在元素周期表中金属与非金属的分界线附近,可以找到半导体材料 | |
| D. | X2+的核外电子数目为18,则X处于笫三周期第ⅡA族 |
1.某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了一系列实验,实验结果记录如下
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所做的电极(正极或负极)不相同(填“相同”或“不同”).
(2)对实验3完成下列填空
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
(3)实验4中铝作负极,理由是Al失去电子,写出铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.
| 编号 | 电极材料 | 电解质溶液 | 电液计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所做的电极(正极或负极)不相同(填“相同”或“不同”).
(2)对实验3完成下列填空
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
(3)实验4中铝作负极,理由是Al失去电子,写出铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.
6.下列变化过程中表示的能量转化关系错误的是( )
| A. | 金属镁燃烧:化学能→热能和光能 | B. | 原电池:化学能→电能 | ||
| C. | 植物的光合作用:太阳能→热能 | D. | 太阳能热水器:光能→热能 |
 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源. 氮化硼(NB)有六方氮化硼和立方氮化硼等不同结构,是一种重要的功能陶瓷材料.请回答下列问题:
氮化硼(NB)有六方氮化硼和立方氮化硼等不同结构,是一种重要的功能陶瓷材料.请回答下列问题: 2-.
2-. 在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题:
在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题: