题目内容
7.物质的量相同的碳酸钠和碳酸氢钠分别跟过量盐酸反应,下列说法正确的是( )| A. | 碳酸钠放出CO2多 | B. | 碳酸氢钠放出CO2多 | ||
| C. | 碳酸钠消耗盐酸多 | D. | 碳酸氢钠消耗盐酸多 |
分析 根据Na2CO3和NaHCO3分别与HCl反应的化学方程式:NaHCO3+HCl=NaCl+H2O+CO2↑;Na2CO3+2HCl=2NaCl+H2O+CO2↑进行判断.
解答 解:NaHCO3与HCl反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;Na2CO3与HCl反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;由以上两个化学方程式可以看出,
A、等物质的量的Na2CO3和NaHCO3分别与HCl反应,产生CO2的物质的量之比为1:1,故A错误;
B、等物质的量的Na2CO3和NaHCO3分别与HCl反应,产生CO2的物质的量一样多,故B错误;
C、等物质的量的Na2CO3和NaHCO3分别与HCl反应,碳酸钠消耗盐酸多于碳酸氢钠,故C正确;
D、等物质的量的Na2CO3和NaHCO3分别与HCl反应,碳酸钠消耗盐酸多于碳酸氢钠,故D错误.
故选C.
点评 本题主要考查了Na2CO3和NaHCO3的性质,注意反应的方程式书写是关键,试题内容简单,只要掌握基础知识就可完成.

练习册系列答案
相关题目
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 强酸性溶液中:Mg2+、K+、SO42-、NO3- | |
| B. | 强碱性溶液中:Na+、Cu2+、H CO3-、NO3- | |
| C. | AgNO3 溶液中:H+、K+、SO42-、Cl- | |
| D. | Ba(NO3)2 溶液中:Mg2+、K+、SO42-、Cl- |
15.下列对“钾和钠性质相似”这个事实的解释最恰当的是( )
| A. | 它们都是金属元素 | B. | 它们的原子半径相差不大 | ||
| C. | 它们的最外层电子数相同 | D. | 它们的最高化合价相同 |
2.下列物质中,属于电解质的是( )
| A. | CO2 | B. | 乙醇 | C. | CaCO3 | D. | 铜 |
12.下列有关0.2mol•L-1 BaCl2溶液的说法正确的是( )
| A. | 1L溶液中Cl-离子浓度为0.2mol•L-1 | |
| B. | 1L溶液中Ba2+离子浓度为0.2mol•L-1 | |
| C. | 1L溶液中Cl-离子总数为0.2NA | |
| D. | 1L溶液中Ba2+和Cl-离子总数为0.6NA |
19.下列物质既不是电解质,又不是非电解质的是( )
| A. | NaHSO4 | B. | Cu(OH)2 | C. | O2 | D. | HCl |
16.下列物质的系统命名中,错误的是( )
| A. | 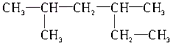 2,4-二甲基己烷 | |
| B. | 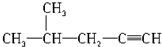 2-甲基-4-戊炔 | |
| C. | 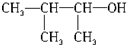 3-甲基-2-丁醇 | |
| D. | CH3-CHBr-CHBr-CH3 2,3-二溴丁烷 |
17.下列说法正确的是( )
| A. | 现代元素周期表中,元素按照元素的相对原子质量递增顺序排列 | |
| B. | 最外层电子数相同的不同元素一定处于同-主族 | |
| C. | 在元素周期表中金属与非金属的分界线附近,可以找到半导体材料 | |
| D. | X2+的核外电子数目为18,则X处于笫三周期第ⅡA族 |