题目内容
12.碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的以碘离子形式存在的碘元素.在实验室中,从海藻里提取碘有流程和实验装置如图所示: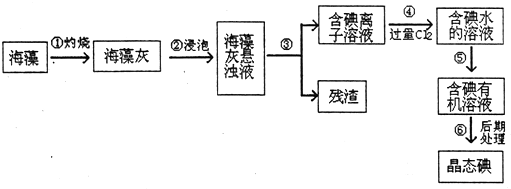
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③过滤,步骤⑤萃取.
(2)写出步骤④对应反应的离子方程式Cl2+2I-═I2+2Cl-.
(3)步骤④中若不用氯气,可以选择滴加稀硫酸,再加入H2O2,则该反应的离子方程式是2H++2I-+H2O2═I2+2H2O.
(4)在步骤⑤中提取碘的过程中,可选择的有机试剂是CD.
A.酒精 B.醋酸 C.四氯化碳 D.苯
(5)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的两种玻璃仪器是分液漏斗;普通漏斗.
(6)请设计出一种检验提取碘后的水溶液中是否还含有单质碘的简单方法取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果变蓝,说明还有单质碘.
(7)假设海藻中的碘元素都是以KI形式存在的.在本实验中,如果灼烧的干海藻的质量为m1 g,在提取过程中有16.6%的碘元素损失,最后获得晶体碘质量为m2 g,则该海藻中含KI的质量分数为$\frac{{m}_{2}}{1.27{m}_{1}}$×100%(用含m1、m2的式子表示)
分析 海带灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质,溶于水,过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用苯或四氯化碳萃取,经蒸馏可得到碘,以此解答该题.
(1)过滤操作的定义是将固体和液体分开,③是固体和液体分离用过滤方法,⑤是水溶液中碘单质被四氯化碳萃取的实验方法;
(2)氯气可以将碘离子氧化为单质碘;
(3)氯气的作用是其氧化性,可以用氢离子和过氧化氢代替将碘离子氧化为单质碘;
(4)萃取时需要的溶剂不能与水互溶;
(5)分液漏斗和普通漏斗的作用分别为萃取和过滤,碘的水溶液,用苯或四氯化碳萃取,经蒸馏可得到碘,分液萃取的实验中需要用分液漏斗和烧杯;
(6)检验溶液中是否含有碘的方法是用淀粉溶液等知识点来解题;
(7)依据碘元素守恒计算碘化钾的质量分数.
解答 解:(1)将浑浊液分成溶液和残渣的方法为过滤操作,将碘从水溶液中转移到有机相中的过程为萃取,③是固体和液体分离用过滤方法,⑤是水溶液中碘单质被四氯化碳萃取的实验方法,
故答案为:过滤;萃取;
(2)加入过量氯气是为了将溶液中的碘离子转化为单质碘,离子方程式为Cl2+2I-═I2+2Cl-,故答案为:Cl2+2I-═I2+2Cl-;
(3)加入氢离子和过氧化氢起的作用为氧化剂,将碘离子转化为单质碘,离子方程式为2H++2I-+H2O2═I2+2H2O,
故答案为:2H++2I-+H2O2═I2+2H2O;
(4)酒精和醋酸虽然也属于有机溶剂,但它们与水可以互溶,故只能选择CD四氯化碳和苯,故答案为:CD;
(5)分液漏斗用来萃取,普通漏斗用来过滤,恰好少了这两种玻璃仪器,故答案为:分液漏斗;普通漏斗;
(6)检验提取碘后的水是否有残余的单质碘,可以取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果变蓝,说明还有单质碘.
故答案为:取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果变蓝,说明还有单质碘;
(7)灼烧的干海藻的质量为m1 g,最后获得晶体碘质量为m2 g,碘元素物质的量=$\frac{{m}_{2}}{254}$mol,在提取过程中有16.6%的碘元素损失,原干海藻中碘元素=$\frac{\frac{{m}_{2}}{254}}{1-16.6%}$mol=$\frac{\frac{{m}_{2}}{254}}{83.4%}$mol,则该海藻中含KI的质量分数=$\frac{\frac{\frac{{m}_{2}}{254}}{83.4%}mol×166g/mol}{{m}_{1}}$×100%=≈$\frac{{m}_{2}}{1.27{m}_{1}}$×100%,
故答案为:$\frac{{m}_{2}}{1.27{m}_{1}}$×100%.
点评 本题考查了过滤操作、萃取和蒸馏中的注意事项,将碘离子转化为单质碘可以用氯气或酸性双氧水,检验单质碘的方法等知识点,题目难度中等.

| A. | CO2 | B. | 乙醇 | C. | CaCO3 | D. | 铜 |
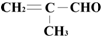 的化学性质叙述正确的是( )
的化学性质叙述正确的是( )| A. | 能发生氧化反应 | |
| B. | 与H2发生加成反应,必定得一种纯的新有机物 | |
| C. | 能发生加聚反应生成高聚物 | |
| D. | 检验-CHO可用酸性KMnO4溶液 |
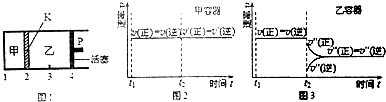
| A. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数分别为增大和减小 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率 变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
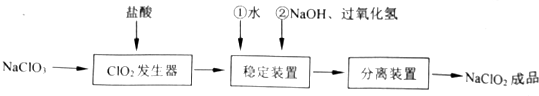
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.
(2)在NaClO2稳定装置中,H2O2作B(选填序号).
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是BEA(按实验先后顺序填写操作代号)
A.过滤 B.加热蒸发 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当PH≤2.0时,ClO2-能被I-完全还原成Cl-;溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
②若上述滴定操作中用去了VmL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×1{0}^{-2}VC}{4W}$×100%(用字母表示).
| A. | 现代元素周期表中,元素按照元素的相对原子质量递增顺序排列 | |
| B. | 最外层电子数相同的不同元素一定处于同-主族 | |
| C. | 在元素周期表中金属与非金属的分界线附近,可以找到半导体材料 | |
| D. | X2+的核外电子数目为18,则X处于笫三周期第ⅡA族 |
| 编号 | 电极材料 | 电解质溶液 | 电液计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所做的电极(正极或负极)不相同(填“相同”或“不同”).
(2)对实验3完成下列填空
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
(3)实验4中铝作负极,理由是Al失去电子,写出铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.
