题目内容
13.X、Y、Z、W为四种短周期主族元素.其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )| A. | Y、Z两元素的简单离子的半径Y>Z | |
| B. | Y元素最高价氧化物对应水化物的化学式为H2YO4 | |
| C. | 原子序数由小到大的顺序为W<X<Y<Z | |
| D. | X与W可以形成W2X、W2X2两种化合物 |
分析 X、Y、Z、W为四种短周期主族元素,X原子最外层电子数是核外电子层数的3倍,则X为O元素,X、Z同族,则Z为S元素;Y的最高正价与最低负价的代数和为6,则Y的最高价为+7价,且与硫同周期,所以Y为Cl元素;W与X、Y既不同族也不同周期,W为H元素,以此解答该题.
解答 解:X、Y、Z、W为四种短周期主族元素,X原子最外层电子数是核外电子层数的3倍,则X为O元素,X、Z同族,则Z为S元素;Y的最高正价与最低负价的代数和为6,则Y的最高价为+7价,且与硫同周期,所以Y为Cl元素;W与X、Y既不同族也不同周期,W为H元素,
A.Y、Z的简单离子的核外电子排布相同,核电荷数越大离子半径越小,故A错误;
B.Y为Cl元素,Cl元素最高价氧化物对应水化物化学式为HClO4,故B错误;
C.原子序数应为H<O<S<Cl,即Y的最大,故C错误;
D.X为O,W为H,可以形成H2O、H2O2两种化合物,故D正确.
故选D.
点评 本题考查位置结构性质的相互关系应用,题目难度不大,本题注意把握如何从化合价的角度推断元素的种类,学习中注重把握元素周期律的主要内容.

练习册系列答案
相关题目
3.燃烧法是测定有机化合物分子式的一种重要方法.完全燃烧0.1mol某烃后测得生成的CO2体积为13.44L (标准状况),生成的H2O为12.6g,该烃的同分异构体数目为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
4.锂~碘电池可用来为心脏起搏器提供能源,其电池反应可表示为:2Li+I2→2LiI.下列有关说法错误的是( )
| A. | 放电时化学能转化为电能 | B. | 负极反应为:Li-e=Li+ | ||
| C. | 正极反应为:I2+2e-=2I- | D. | 电流由负极流向正极 |
1.“无土栽培”是一项利用化学试剂配成的营养液来栽培植物的新技术.下列是某营养液所含的主要成分,其中属于复合肥料的是( )
| A. | KNO3 | B. | CO(NH2)2 | C. | Ca(H2PO4)2 | D. | (NH4)2SO4 |
8.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:HCl>HI | B. | 原子半径:Na>Mg | ||
| C. | 结合质子能力:S2->Cl- | D. | 酸性:H2SO3>H2SO4 |
18.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | PCl3 | B. | XeF2 | C. | SF6 | D. | BF3 |
5.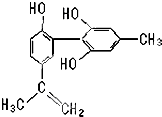 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 该分子中的所有碳原子不可能共平面 | |
| C. | 滴入KMnO4(H+)溶液,观察紫红色变浅,仅是因为结构中存在碳碳双键 | |
| D. | 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和 H2分别为4mol、7mol |
3.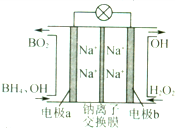 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其丁作原理如图所示.下列说法中错误的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其丁作原理如图所示.下列说法中错误的是( )
 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其丁作原理如图所示.下列说法中错误的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其丁作原理如图所示.下列说法中错误的是( )| A. | 电池放电时Na+从a极区移向b极区 | |
| B. | 电极b采用Mn O2,Mn O2既做电极材料又有催化作用 | |
| C. | 该电池的负极反应为BH${\;}_{4}^{-}$+8OH-一8e-═BO${\;}_{2}^{-}$+6H2O | |
| D. | 每消耗3molH2O2,转移的电子为3mol |
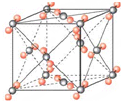 干冰晶胞如图所示,边长a=5.72×10-8cm,该温度下干冰的密度为1.56g/cm3
干冰晶胞如图所示,边长a=5.72×10-8cm,该温度下干冰的密度为1.56g/cm3