题目内容
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,式量248) 可用于照相行业的定影剂。它易溶于水,且溶解度随温度升高而显著增大,难溶于乙醇,加热时易分解,实验室模拟工业制备硫代硫酸钠晶体通常有两种方法。(硫单质不溶于水,微溶于酒精)
I 亚硫酸钠法:Na2SO3+S+5H2O=Na2S2O3·5H2O,简易实验流程如下:
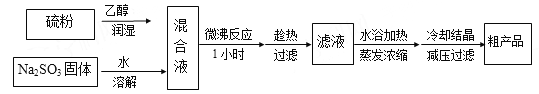
(1)硫粉用乙醇润湿的目的是 ;
(2)洗涤粗产品,下列洗涤剂最合适的是 ;
A.冰水 B.热水 C.乙醇 D.乙醇-水混合溶液
(3)所得粗产品一般通过 方法提纯;
II硫化碱法:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,主要实验装置如下:

(4)装置C中可放入 ;
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(5)为测定粗产品中Na2S2O35H2O的纯度。某兴趣小组称取5.0 g粗产品配成250mL溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点。实验数据如下表:
滴定次数 | 1 | 2 | 3 |
消耗Na2S2O3溶液(mL) | 19.98 | 21.18 | 20.02 |
该产品的纯度是 ;
(6)硫代硫酸钠产率受温度、pH影响如下图:

下列说法不正确的是 。
A.生成Na2S2O3一定是放热反应
B. 制备应采取较低温度
C.Na2S2O3一定能和0.1mol·L-1的硫酸发生反应
D.控制pH和温度,可以提高Na2S2O3的产率
【答案】(1)有利于Na2SO3与硫粉充分接触,增大反应速率
(2)C) (3)重结晶 (4)CD (5)93% (6)A
【解析】
试题分析:(1)乙醇易溶于水,硫粉用乙醇润湿,有利于硫粉与亚硫酸钠溶液充分接触,加快反应速率;
(2)为减少产品洗涤时溶解于水引起损失,可选择乙醇洗涤粗产品,答案为C;
(3)硫代硫酸钠的溶解度随温度升高而显著增大,降低温度,采用重结晶法制取粗产品;
(4)装置C主要是尾气处理,吸收反应生成的CO2和多余的SO2,防止污染大气故可选择酸性高锰酸钾浓度或NaOH溶液,答案为CD;
(5)在锥形瓶中加入25mL 0.0lmolL-1KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+═3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-═2I-+S4O62-,
则可得关系式:IO3-~6S2O32-,
1mol 6mol
0.025L×0.0lmolL-1 n(S2O32-)
则n(S2O32-)=0.0015mol,
第三次实验的数据误差较大,舍去,
所以250mL硫代硫酸钠溶液中硫代硫酸钠的物质的量为0.0015mol×![]() =0.01875mol,则硫代硫酸钠的质量为0.01875mol×248g/mol=4.65g,
=0.01875mol,则硫代硫酸钠的质量为0.01875mol×248g/mol=4.65g,
则该产品的纯度是![]() ×100%=93%;
×100%=93%;
(6)由图表可知硫代硫酸钠产率在相同pH时温度高产率低,在相同温度下pH升高,准备产率升高;A.温度高产率低,但不一定说明生成Na2S2O3的反应是放热反应,故A错误;B. 由图表可知制备应采取较低温度,因低温下产率较高,故B正确;C.pH越小产率越低,说明Na2S2O3一定能和0.1mol·L-1的硫酸发生反应,故C正确;D.依据图表可控制pH和温度,提高Na2S2O3的产率,故D正确,答案为A。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案