题目内容
【题目】某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)

回答下列问题:
(1)装置B中发生反应的化学方程式是 。
(2)B、E两处酒精灯,必须后点燃的是 。
(3)E中出现 的现象。
(4)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体。
①欲检验溶液中含有Fe3+,选用的试剂为 ,现象是 。
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+,可能的的原因: 。
③在此溶液中加入少量酸性高锰酸钾溶液,高锰酸钾褪色,溶液中反应的离子方程式 。
④将此滤液中FeCl2完全氧化为FeCl3最好选择 做氧化剂。
【答案】(1) 3Fe + 4H2O(g) ![]() Fe3O4 + 4H2;(2)E;
Fe3O4 + 4H2;(2)E;
(3)黑色氧化铜变红,玻璃管右端出现无色液滴;
(4)①硫氰化钾(KSCN);溶液变红;②2Fe3+ + Fe =3Fe2+;
③5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;④Cl2。
【解析】
试题分析:(1)B中铁和水蒸气发生反应,其反应方程式为:3Fe + 4H2O(g) ![]() Fe3O4 + 4H2;
Fe3O4 + 4H2;
(2)氢气还原氧化铜,操作是先通一段时间的氢气,把装置中空气排尽,点燃酒精灯,最后让铜在氢气中冷却,因此显然先点燃B,后点燃E;
(3)H2+CuO![]() H2O+Cu,现象:黑色氧化铜变红,玻璃管右端出现无色液滴;
H2O+Cu,现象:黑色氧化铜变红,玻璃管右端出现无色液滴;
(4)①检验Fe3+的存在,一般采用KSCN溶液,如果溶液变红,说明含有Fe3+;②没有检测到Fe3+,可能铁没有完全反应,Fe+2Fe3+=3Fe2+;③根据②的分析,溶液中含有Fe2+,Fe2+具有还原性,能使酸性高锰酸钾溶液褪色,Fe2+被氧化成Fe3+,MnO4-被还原成Mn2+,离子反应方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;④不能引入新杂质,可以通入氯气或加入过氧化氢。

【题目】硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:

(1) 完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +_______+H2O;双氧水的作用是____ 。
(2) 步骤②调节溶液pH,可以选用的试剂是______
A. CuO B.Fe2O3 C.Al2O3 D Cu(OH)2
(3) 有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为 、 。
(4) 将滤液B通过 、 ,过滤等操作可得到硫酸铜晶体。
(5) 测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果__ ___(填“偏高”、“偏低”或“不变”)。
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,式量248) 可用于照相行业的定影剂。它易溶于水,且溶解度随温度升高而显著增大,难溶于乙醇,加热时易分解,实验室模拟工业制备硫代硫酸钠晶体通常有两种方法。(硫单质不溶于水,微溶于酒精)
I 亚硫酸钠法:Na2SO3+S+5H2O=Na2S2O3·5H2O,简易实验流程如下:

(1)硫粉用乙醇润湿的目的是 ;
(2)洗涤粗产品,下列洗涤剂最合适的是 ;
A.冰水 B.热水 C.乙醇 D.乙醇-水混合溶液
(3)所得粗产品一般通过 方法提纯;
II硫化碱法:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,主要实验装置如下:
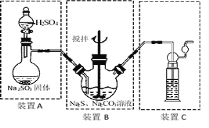
(4)装置C中可放入 ;
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(5)为测定粗产品中Na2S2O35H2O的纯度。某兴趣小组称取5.0 g粗产品配成250mL溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点。实验数据如下表:
滴定次数 | 1 | 2 | 3 |
消耗Na2S2O3溶液(mL) | 19.98 | 21.18 | 20.02 |
该产品的纯度是 ;
(6)硫代硫酸钠产率受温度、pH影响如下图:

下列说法不正确的是 。
A.生成Na2S2O3一定是放热反应
B. 制备应采取较低温度
C.Na2S2O3一定能和0.1mol·L-1的硫酸发生反应
D.控制pH和温度,可以提高Na2S2O3的产率