题目内容
【题目】为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。
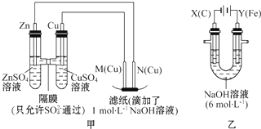
I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是_____ (填字母)。
A石墨 B. 镁 C.银 D.铂
(2)实验过程中,SO42-____(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象是________________。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极处溶液的OH-浓度____(填“增大”“减小”或“不变)。
(4)电解过程中,Y极发生的电极反应为___________________,_________________。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电板(铁电极)质量减小0.28g,则在Y极收集到气体为____mL(均己折算为标准状况时气体体积)。
(6)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应总反应式为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为_______________。
【答案】B 从右向左 滤纸上有蓝色沉淀产生(答出“蓝色沉淀”或“蓝色斑点”即可) 增大 4OH--4e-=2H2O+O2↑ Fe-6e-+8OH-=FeO42-+4H2O 168 2FeO42-+6e-+5H2O=Fe2O3+10OH-
【解析】
I.甲装置是原电池,Zn作负极,Cu作正极,利用该原电池电解氢氧化钠溶液,结合原电池、电解池的工作原理解答。
II.乙装置是电解池,铁电极与电源正极相连,作阳极,铁失去电子,碳棒是阴极,氢离子放电,结合电极反应式以及电子得失守恒解答。
(1)甲装置是原电池,Zn作负极,Cu作正极。若要保证电极反应不变,则另一个电极的活动性只要比Zn弱即可。根据金属活动性顺序可知Mg>Zn,因此不能是Mg,答案选B。
(2)根据同种电荷相互排斥,异种电荷相互吸引的原则,实验过程中,SO42会向正电荷较多的Zn电极方向移动。即从右向左移动。利用该原电池电解氢氧化钠溶液,由于电极均是铜,在阳极上发生反应Cu-2e-=Cu2+,产生的Cu2+在溶液中发生反应Cu2++2OH-=Cu(OH)2↓,所以在滤纸上能观察到的现象是有蓝色沉淀产生。
(3)由图可知:X为阴极。电解过程中,X极上发生:2H++2e-=H2↑,破坏了水的电离平衡,水继续电离,最终导致溶液的c(OH-)增大,所以X极处溶液的c(OH-)增大。
(4)由于实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。又因为高铁酸根(FeO42-)在溶液中呈紫红色,所以在电解过程中,Y极发生的电极反应为4OH-4e=2H2O+O2↑和Fe-6e+8OH=FeO42+4H2O;
(5)X电极产生氢气,n(H2)=0.672L÷22.4L/mol=0.03mol,n(e-)=0.06mol。在整个电路中电子转移数目相等,则4×n(O2)+6×(0.28g÷56g/mol)=0.06mol,解得n(O2)=0.0075mol,所以V(O2)=0.0075mol×22.4L/mol=0.168L=168mL;
(6)K2FeO4-Zn也可以组成碱性电池,Zn作负极,负极的电极反应式为3Zn-6e-+6OH-=3Zn(OH)2。K2FeO4在电池中作为正极材料,其电池反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2。用总反应式减去负极电极式可得该电池正极发生的电极反应式为2FeO42+6e+5H2O=Fe2O3+10OH。