题目内容
17. 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )| A. | 该能量转化系统中的水也是可能循环的 | |
| B. | 燃料电池系统产生的能量实际上来自于水 | |
| C. | 水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑ | |
| D. | 燃料电池放电时的正极反应:O2+4e-+2H2O=4OH - |
分析 根据空间站能量转化系统局部示意图,利用水的分解反应和燃料电池中的反应来分析反应中的能量变化,向阳面时,发生的是电解反应,背日面时,发生的是原电池反应.
解答 解:A.由转化图可知,该系统中水既可分解也可生成,是循环使用的,故A正确;
B.燃料电池系统产生的能量来源于所发生的化学反应,化学反应的能量来自太阳能,燃料电池系统产生的能量实际上来自太阳能,故B错误;
C.水电解时,阳极上氢氧根离子失电子生成水和氧气,电极反应式为4OH--4e-=2H2O+O2↑,故C正确;
D.燃料电池放电时,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,故D正确.
故选B.
点评 本题利用信息来考查化学与能源问题,难度不大,注重了与生活实际的紧密联系,也体现了利用所学课本知识能够学以致用.

练习册系列答案
相关题目
7.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O?3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
| A. | 放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OHFeO${\;}_{4}^{2-}$+4H2O | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被还原 | |
| D. | 充电时阴极溶液的碱性减弱 |
8.下列化学方程式或离子方程式正确的是( )
| A. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2O | |
| B. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓ | |
| D. | 向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
12.下列叙述或解释事实的方程式错误的是( )
| A. | pH=1的NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) | |
| B. | 0.1 mol•L-1 CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| C. | 用NaHCO3溶液做导电实验,灯泡发光:NaHCO3=Na++H++CO32- | |
| D. | 盛满NO2的烧瓶浸泡在冷水中,颜色变浅:NO2 (g,红棕色)?N2O4(g,无色)△H<0 |
2.常温下用0.1000mol/L盐酸滴定20.00mL0.1000mol/LNH3•H2O溶液,滴定曲线如图所示,下列说法正确的是( )
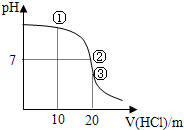

| A. | ①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)=c(Cl-)=c(OH-)=c(H)+ | |
| C. | ③溶液:含有的微粒数为5种 | |
| D. | 滴定过程中可能出现:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
9.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 100mL0.2mol•L-1的AlCl3溶液中,含阳离子数目小于0.02NA | |
| B. | 标况下30 L pH=11的Na2CO3溶液中含有的OH-数为0.03NA | |
| C. | 10 mL质量分数为98%的H2SO4溶液,用水稀释至100 mL,所得H2SO4的质量分数大于9.8% | |
| D. | 11 g超重水(T2O)含中子数为5NA |
6.下列有关化学用语表示正确的是( )
| A. | 中子数为21的钾原子:${\;}_{19}^{40}$K | |
| B. | 氯化钡的电子式:Ba2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{ci}}{••}$${\;}_{•}^{•}$]${\;}_{2}^{-}$ | |
| C. | N3-的结构示意图: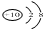 | |
| D. | 聚2-甲基-1,3-丁二烯的结构简式: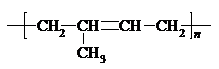 |
11.对相同物质的质量的SO2和SO3来说,下列关系不正确的是( )
| A. | 含氧原子个数比为2:3 | B. | 含硫元素质量比为1:1 | ||
| C. | 含氧元素质量比为5:6 | D. | 含硫原子个数比为1:1 |