题目内容
【题目】将14gNa2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12L,所得溶液的体积为400mL,则所得溶液的物质的量浓度为( )
A. 2mol·L-1B. 1mol·L-1C. 3mol·L-1D. 4mol·L-1
【答案】B
【解析】
Na2O和Na2O2均能与水反应,反应的化学方程式分别为Na2O+H2O=2NaOH和2Na2O2+2H2O=4NaOH + O2↑,标准状况下1.12L氧气的物质的量为![]() =0.05mol,由化学方程式可知混合物中过氧化钠的物质的量为n(Na2O2)=2n(O2)=0.05mol×2=0.1mol,则混合物中氧化钠的物质的量为n(Na2O)=
=0.05mol,由化学方程式可知混合物中过氧化钠的物质的量为n(Na2O2)=2n(O2)=0.05mol×2=0.1mol,则混合物中氧化钠的物质的量为n(Na2O)=![]() =0.1mol,反应后溶液中的溶质为氢氧化钠,根据钠原子守恒可得氢氧化钠的物质的量为n(NaOH)=2n(Na2O2)+2n(Na2O)=0.1mol×2+0.1mol×2=0.4mol,所得溶液中溶质的物质的量浓度为c(NaOH)=
=0.1mol,反应后溶液中的溶质为氢氧化钠,根据钠原子守恒可得氢氧化钠的物质的量为n(NaOH)=2n(Na2O2)+2n(Na2O)=0.1mol×2+0.1mol×2=0.4mol,所得溶液中溶质的物质的量浓度为c(NaOH)=![]() =1mol/L,故选B。
=1mol/L,故选B。

【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
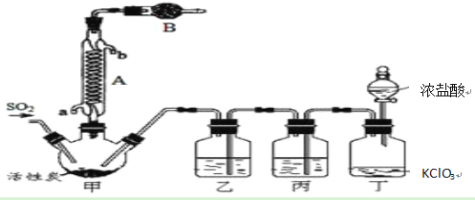
(1)仪器A冷却水的进水口为________(填“a”或“b”)。
(2)仪器B中盛放的药品是________,其目的是________________________。
(3)实验时,装置丁中发生反应的离子方程式为______________________________,当生成6.72L的氯气(标况下),转移电子的物质的量为________。
(4)装置丙中盛放的试剂是________,若缺少装置乙,对实验造成的影响是_______________。
(5)少量硫酰氯也可用液态氯磺酸(ClSO3H)低温催化分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 +SO2Cl2,从分解产物中分离出硫酰氯的操作是______________。