题目内容
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
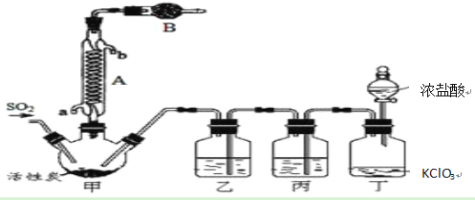
(1)仪器A冷却水的进水口为________(填“a”或“b”)。
(2)仪器B中盛放的药品是________,其目的是________________________。
(3)实验时,装置丁中发生反应的离子方程式为______________________________,当生成6.72L的氯气(标况下),转移电子的物质的量为________。
(4)装置丙中盛放的试剂是________,若缺少装置乙,对实验造成的影响是_______________。
(5)少量硫酰氯也可用液态氯磺酸(ClSO3H)低温催化分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 +SO2Cl2,从分解产物中分离出硫酰氯的操作是______________。
【答案】a 碱石灰 吸收尾气并防止空气中水蒸气进入反应装置导致产品水解 ClO3-+5Cl-+ 6H+=3Cl2↑+3H2O 0.5NA 饱和氯化钠溶液 SO2Cl2发生水解 蒸馏
【解析】
二氧化硫和氯气合成硫酰氯:甲装置:SO2(g)+Cl2(g)![]() SO2Cl2,硫酰氯会水解,仪器B中盛放的药品是碱石灰防止空气中的水蒸气进入装置,同时吸收挥发出去的二氧化硫和氯气,丁装置:浓盐酸和氯酸钾反应制取氯气,浓盐酸易挥发,制取的氯气中含有氯化氢,丙装置:除去Cl2中的HCl,乙装置:干燥氯气。
SO2Cl2,硫酰氯会水解,仪器B中盛放的药品是碱石灰防止空气中的水蒸气进入装置,同时吸收挥发出去的二氧化硫和氯气,丁装置:浓盐酸和氯酸钾反应制取氯气,浓盐酸易挥发,制取的氯气中含有氯化氢,丙装置:除去Cl2中的HCl,乙装置:干燥氯气。
(1)根据采用逆流的冷凝效果好,判断冷凝管的进水口;
(2)仪器B中盛放的药品是碱石灰防止空气中的水蒸气进入装置,同时吸收挥发出去的二氧化硫和氯气;
(3)实验时,装置丁中氯酸钾+5价的氯和盐酸中-1价的氯发生氧化还原反应生成氯气;根据化合价升降以及生成物的量计算转移电子数;
(4)盐酸易挥发,制取的氯气中含有氯化氢,丙装置的作用是除去Cl2中的HCl,由此目的选择试剂;SO2Cl2遇水生成硫酸和氯化氢;
(5)二者均为液态,且沸点相差较大,采取蒸馏法进行分离。
(1)冷凝管采用逆流时冷凝效果好,所以冷凝管中的冷却水进口为a;
(2)甲装置:SO2(g)+Cl2(g)![]() SO2Cl2,二氧化硫、氯气为有毒的酸性气体,产物硫酰氯会水解,所以仪器B中盛放的药品是碱性物质碱石灰,可防止空气中的水蒸气进入装置,同时吸收挥发出去的二氧化硫和氯气;
SO2Cl2,二氧化硫、氯气为有毒的酸性气体,产物硫酰氯会水解,所以仪器B中盛放的药品是碱性物质碱石灰,可防止空气中的水蒸气进入装置,同时吸收挥发出去的二氧化硫和氯气;
(3)浓盐酸和氯酸钾发生反应生成KCl、氯气和水,反应为:6HCl(浓)+KClO3=KCl+3Cl2↑+3H2O,离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;根据归中反应同元素化合价“只靠近,不交叉”原则可知,氯酸钾+5价的氯降低为0价,盐酸中-1价的氯升高为0价,即每生成3molCl2,其转移电子为5mol,故当生成0.3molCl2,转移电子数目为0.5NA;
(4)盐酸易挥发,制取的氯气中含有氯化氢,氯气难溶于饱和食盐水,HCl易溶于水,可用饱和NaCl溶液除去Cl2中的少量HCl;装置乙中试剂为浓硫酸,其作用是除去Cl2中的水,若缺少装置乙,SO2Cl2遇水发生水解反应生成硫酸和氯化氢;
(5)由题干表格可知,低温条件下,SO2Cl2和H2SO4均为液态,二者会互溶,且沸点相差较大,可采取蒸馏法进行分离。

 阅读快车系列答案
阅读快车系列答案