题目内容
9. 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:(1)在A图中画出必要的连线或装置,使连接后的装置为原电池.电极反应方程式:
铁板:Fe-2e=Fe2+;
碳棒:Cu2++2e=Cu.
(2)在B图中画出必要的连线或装置,使连接后的装置,为电解池并使铁板上有红色物质生成出,则电极反应反应式:
铁板:Cu2+-2e=Cu
碳棒:2Cl--2e-═Cl2↑.
分析 (1)原电池的构成条件:活泼性不同的两个电极,闭合回路,电解质溶液;自发的氧化还原反应,负极上是金属失电子的氧化反应,正极上是得电子的还原反应;
(2)电解池中有金属析出的电极是阴极,根据电极现象确定电极,并书写电极反应.
解答 解:(1)将装置A连接后成为原电池,则根据原电池的构成条件,缺少闭合回路这一条件,只需将两个电极连接即可,活泼金属铁为负极,该极上发生失电子的氧化反应,即Fe-2e=Fe2+,C棒是正极,该极上是铜离子的电子的还原反应,即Cu2++2e=Cu,
故答案为: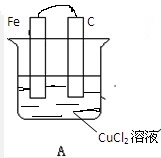 ;Fe-2e=Fe2+;Cu2++2e=Cu;
;Fe-2e=Fe2+;Cu2++2e=Cu;
(2)连接后的装置为电解池,铁板上有红色物质生成,所以铁板是阴极,该极上发生还原反应:Cu2+-2e=Cu,碳棒是阳极,则该极上是氯离子失电子的氧化反应,即2Cl--2e-═Cl2↑,
故答案为: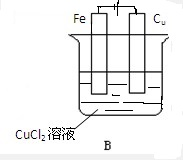 ;Cu2+-2e=Cu;2Cl--2e-═Cl2↑.
;Cu2+-2e=Cu;2Cl--2e-═Cl2↑.
点评 本题考查学生原电池和电解池的工作原理知识,注意电极的确定以及电极反应式的书写是关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3NA | |
| B. | 3.4g NH3中含原子总数目为0.6NA | |
| C. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| D. | 23gNO2和N2O4的混合气体中含有原子总数1.5NA |
17.“纳米材料”是当今材料科学的前沿.所谓“纳米材料”是指研究开发出的直径在几纳米到几十纳米之间的材料.若将纳米材料分散到分散剂中,所形成的混合物可能具有的性质是( )
| A. | 能全部透过半透膜 | B. | 有丁达尔现象 | ||
| C. | 不能全部透过滤纸 | D. | 所得物质一定是悬浊液 |
18.现有一体积为V mL、密度为ρ g•cm-3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol•L-1,溶质的质量分数为W,下列表示式中不正确的是( )
| A. | c=$\frac{1000Wρ}{M}$ | B. | m=$\frac{VρW}{10000}$ | C. | W%=$\frac{cM}{1000ρ}$% | D. | c=$\frac{1000m}{VM}$ |
19. 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0,在673K、30Mpa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0,在673K、30Mpa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0,在673K、30Mpa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0,在673K、30Mpa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点c处反应达到平衡 | |
| B. | 点a的正反应速率比点b的大 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其它条件不变,773K下反应至t1时刻,n(H2)比图中d点的值小 |