题目内容
1.现用质量分数为98%、密度为1.84g•cm-3的浓H2SO4来配制500mL 0.2mol•L-1的稀H2SO4.请回答下列问题:(1)本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的玻璃仪器是500 mL容量瓶、胶头滴管.
(2)经计算,需浓H2SO4的体积为5.4 mL.现有①10mL ②50mL ③100mL三种规格的量筒,你选用的量筒是①(填序号).
(3)配制时,一般分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为B.
A.②①③⑧⑤⑦⑥④B.②①③⑧⑤⑥⑦④C.②①③⑤⑥⑦④⑧
(4)配制过程中,下列操作会引起结果偏高的是②④(填序号)
①未洗涤烧杯和玻璃棒
②H2SO4溶液未冷却至室温就转移到容量瓶中
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线..
分析 (1)依据配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、定容、摇匀等,据此选择合适的仪器;
(2)先计算浓硫酸的物质的量浓度,再根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸的体积,据此选择合适的量筒;
(3)依据配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、定容、摇匀等排序;
(4)分析不当操作对溶质的物质的量浓度和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)依据配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、定容、摇匀等,用到的玻璃仪器有:烧杯、量筒、玻璃棒、500mL容量瓶、胶头滴管,还缺少的玻璃仪器为:500mL容量瓶、胶头滴管;
故答案为:胶头滴管、500 mL容量瓶;
(2)浓硫酸的物质的量浓度为$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸的体积为V,根据溶液稀释前后溶质的物质的量不变得:0.2mol/L×0.5L=18.4mol/L×V,V=0.0054L=5.4mL,应选择10mL量筒;
故答案为:5.4;①;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、定容、摇匀等,所以正确的顺序为:②①③⑧⑤⑥⑦④;
故选:B;
(4)①未洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液的浓度偏低,故不选;
②H2SO4溶液未冷却至室温就转移到容量瓶中,定容后液面下降,导致溶液的体积偏低,溶液的浓度偏高,故选;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液的体积无影响,溶液的物质的量浓度不变,故不选;
④定容时俯视刻度线,导致溶液的体积偏小,溶液的浓度偏高;
故选:②④.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和过程即可解答,注意误差分析的方法和技巧,题目难度不大.

 生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )
生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )| A. | 聚苯乙烯能使溴水褪色 | |
| B. | 聚苯乙烯是一种天然高分子化合物 | |
| C. | 聚苯乙烯可由苯乙烯通过化合反应制得 | |
| D. | 聚苯乙烯单体的分子式为C8H8 |
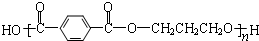 )的说法中正确的是( )
)的说法中正确的是( )| A. | PBT是通过加聚反应得到的高分子化合物 | |
| B. | PBT的单体中有芳香烃 | |
| C. | PBT分子中含有羧基、羟基和酯基 | |
| D. | PBT的单体均能与Na、NaOH、Na2CO3反应 |
| A. | 3,3-二甲基丁烷 | B. | 2,2-二甲基-2-乙基乙烷 | ||
| C. | 2,3-二甲基-4-乙基己烷 | D. | 2,5,5-三甲基己烷 |
| A. | 硫酸铁中加入少量氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 将铝投入CuSO4溶液中:Al+Cu2+═Cu+Al3+ |
 相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如右图所示.则下列叙述正确的是( )
相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如右图所示.则下列叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 反应热:过程I>过程II | |
| C. | 过程Ⅱ的平衡常数>过程I的平衡常数 | |
| D. | 形成1 mol 化学键释放的能量:H-Br<H-H |
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g)△H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g)△H2
③Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H3=+2.1kJ•mol-1
下列说法正确的是( )
| A. | △H1>△H2 | |
| B. | 锡的两种同素异形体在常温下可以相互转化,是可逆反应 | |
| C. | 灰锡转化为白锡的反应是吸热反应 | |
| D. | 锡制器皿应置于高于13.2℃的环境中,否则会自行毁坏 |
 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空: