题目内容
4.某校化学兴趣小组的学生应用如图所示的方法研究氯气的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
(1)图中,浓H2SO4的作用是除去氯气中的水蒸气
(2)实验中,B试剂瓶的实验现象是布条不褪色,C试剂瓶的实验现象是有色布条褪色,导致C中出现相应现象的物质是HClO(填化学式).
(3)为了对尾气进行处理,最后的烧杯中应当加入NaOH溶液,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
分析 (1)氯气中含有水蒸气,要验证干燥氯气不具有漂白性,应除去氯气中的水蒸气;
(2)干燥的有色布条不褪色;湿润的有色布条褪色;是氯气与水反应生成次氯酸漂白;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收,方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
解答 解:(1)氯气中含有水蒸气,要验证干燥氯气不具有漂白性,应除去氯气中的水蒸气,浓硫酸具有吸水性,可以吸收氯气中的水蒸气,故答案为:除去氯气中的水蒸气;
(2)干燥的有色布条不褪色,所以B试剂瓶的实验现象是布条不褪色;湿润的有色布条褪色,所以C试剂瓶的实验现象是有色布条褪色;是氯气与水反应生成次氯酸漂白;故答案为:布条不褪色;有色布条褪色;HClO;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收,方程式为Cl2+2NaOH=NaCl+NaClO+H2O,所以离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:NaOH;Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题为实验题,考查了氯气的性质的检验,明确氯气及次氯酸的性质是解题关键,侧重考查学生分析为题解题问题的能力,注意实验设置的严密性,题目难度不大.

练习册系列答案
相关题目
12.下列有关工程塑料PBT(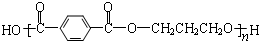 )的说法中正确的是( )
)的说法中正确的是( )
 )的说法中正确的是( )
)的说法中正确的是( )| A. | PBT是通过加聚反应得到的高分子化合物 | |
| B. | PBT的单体中有芳香烃 | |
| C. | PBT分子中含有羧基、羟基和酯基 | |
| D. | PBT的单体均能与Na、NaOH、Na2CO3反应 |
19.同温同压下,同体积的CO和CO2,下列说法正确的是( )
| A. | 分子数之比等于2:3 | B. | 物质的量之比等于1:1 | ||
| C. | 原子数之比等于3:2 | D. | 质量之比等于1:1 |
16.下列物质的命名正确的是( )
| A. | 3,3-二甲基丁烷 | B. | 2,2-二甲基-2-乙基乙烷 | ||
| C. | 2,3-二甲基-4-乙基己烷 | D. | 2,5,5-三甲基己烷 |
13.下列离子方程式书写正确的是( )
| A. | 硫酸铁中加入少量氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 将铝投入CuSO4溶液中:Al+Cu2+═Cu+Al3+ |
14.油脂水解的最终产物是( )
| A. | 酸和甘油 | B. | 水 | C. | CO2 | D. | 水和CO2 |
 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空: