题目内容
20.(1)硬水是指溶有较多的Ca2+、Mg2+的水,由钙镁的碳酸氢盐引起的硬度叫做暂时硬度.暂时硬水常用熟石灰进行软化处理.试写出碳酸氢钙、碳酸氢镁分别与熟石灰反应的离子方程式.(2)1L的混合硫酸、硝酸溶液中,其中c(HNO3)=0.4mol/L,c(H2SO4)=0.2mol/L,放入足量的铜(假设反应后溶液体积不变),求溶液中c(Cu2+)是多少mol/L?
分析 (1)碳酸氢钙与熟石灰反应生成碳酸钙和水,碳酸氢镁与熟石灰反应生成氢氧化镁、碳酸钙、水;
(2)n(HNO3)=1L×0.4mol/L=0.4mol,n(H2SO4)=1L×0.2moL/L=0.2moL,n(H+)=0.4moL+2×0.2moL=0.8mol,结合3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O计算.
解答 解:(1)碳酸氢钙与熟石灰反应生成碳酸钙和水,离子反应为Ca2++HCO3-+OH-═CaCO3↓+H2O,碳酸氢镁与熟石灰反应生成氢氧化镁、碳酸钙、水,离子反应为Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+2H2O+Mg(OH)2↓,
答:离子反应分别为Ca2++HCO3-+OH-═CaCO3↓+H2O、Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+2H2O+Mg(OH)2↓;
(2)n(HNO3)=1L×0.4mol/L=0.4mol,n(H2SO4)=1L×0.2moL/L=0.2moL,n(H+)=0.4moL+2×0.2moL=0.8mol,
由3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O可知,0.8mol氢离子参加反应生成0.3molCu2+,则溶液中c(Cu2+)=$\frac{0.3mol}{1L}$=0.3mol/L,
答:溶液中c(Cu2+)为0.3mol/L.
点评 本题考查离子反应方程式的书写及计算,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应及计算的考查,题目难度不大.

练习册系列答案
相关题目
11.下列化合物中,不能由两种单质直接化合制得的是( )
| A. | FeS | B. | FeCl3 | C. | Fe3O4 | D. | FeCl2 |
11. 生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )
生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )
 生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )
生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )| A. | 聚苯乙烯能使溴水褪色 | |
| B. | 聚苯乙烯是一种天然高分子化合物 | |
| C. | 聚苯乙烯可由苯乙烯通过化合反应制得 | |
| D. | 聚苯乙烯单体的分子式为C8H8 |
8.根据有机化合物的命名原则,下列命名正确的是( )
| A. | 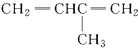 3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | B. |  2-羟基丁烷 2-羟基丁烷 | ||
| C. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | D. | CH3CH(CH3)CH2COOH 3-甲基丁酸 |
12.下列有关工程塑料PBT(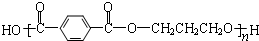 )的说法中正确的是( )
)的说法中正确的是( )
 )的说法中正确的是( )
)的说法中正确的是( )| A. | PBT是通过加聚反应得到的高分子化合物 | |
| B. | PBT的单体中有芳香烃 | |
| C. | PBT分子中含有羧基、羟基和酯基 | |
| D. | PBT的单体均能与Na、NaOH、Na2CO3反应 |
10. 相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如右图所示.则下列叙述正确的是( )
相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如右图所示.则下列叙述正确的是( )
 相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如右图所示.则下列叙述正确的是( )
相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如右图所示.则下列叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 反应热:过程I>过程II | |
| C. | 过程Ⅱ的平衡常数>过程I的平衡常数 | |
| D. | 形成1 mol 化学键释放的能量:H-Br<H-H |
 (1)意大利科学家FulvioCacace等获得了极具理论研究意义的N4分子.N4分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ.根据以上信息和数据,计算1molN4气体转变为N2气体的△H=-882 kJ•mol-1
(1)意大利科学家FulvioCacace等获得了极具理论研究意义的N4分子.N4分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ.根据以上信息和数据,计算1molN4气体转变为N2气体的△H=-882 kJ•mol-1 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空: