题目内容
下列反应既是氧化还原反应,又是吸热反应的是
| A.Ba(OH)2·8H2O与NH4Cl的反应 |
| B.铝片与稀硫酸反应 |
| C.甲烷在空气中燃烧 |
| D.灼热的焦炭与CO2反应 |
D
解析试题分析:凡是有元素化合价升降的反应都是氧化还原反应。B、C都是放热的氧化还原反应;A是吸热反应,但不属于氧化还原反应。D是吸热的氧化还原反应,答案选D。
考点:考查氧化还原反应、放热反应以及吸热反应的判断
点评:该题是基础性试题的考查,难度不大。该题的关键是明确氧化还原反应的判断依据,其次还需要记住常见的放热反应和吸热反应,即一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。

 名校课堂系列答案
名校课堂系列答案研制和开发不含碳并可工业生产的清洁能源,一直是科学家不懈追求的目标,目前液氨被人们视为一种潜在的清洁燃料。液氨燃烧的化学反应方程式为:4NH3+3O2 2N2+6H2O。和氢燃料相比有关数据见下表,据此判断正确的是
2N2+6H2O。和氢燃料相比有关数据见下表,据此判断正确的是
| 燃料 | 沸点(℃) | 燃烧热(kJ/mol) | 相对分子质量 | 液态密度(g/cm3) |
| 氢 | -252.6 | 238.40 | 2.02 | 0.07 |
| 氨 | -33.50 | 317.10 | 17.03 | 0.61 |
①以氨和氢为燃料时,可以减缓温室效应
②氨泄漏到空气中比氢气更易发生爆炸
③等质量的氨和氢分别燃烧,氢放出的热量多
④氨的液化比氢容易得多
A.①③ B.②③ C.①④ D.②④
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g石墨或金刚石完全燃烧时放出的热量依次为Q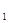 和Q
和Q ,下列说法错误的是
,下列说法错误的是
A.Q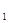 <Q <Q |
| B.石墨不如金刚石稳定 |
| C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低 |
| D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多 |
下列对化学反应的认识正确的是
| A.化学反应必然引起物质状态的变化 |
| B.化学反应一定有化学键的断裂和生成 |
| C.需要加热的反应一定是吸热反应 |
| D.若反应物的总能量高于生成物的总能量,则该反应是吸热反应 |
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是
| A.X的能量一定低于M的,Y的能量一定低于N的 |
| B.因为该反应为吸热反应,故一定要加热反应才能进行 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.反应物X和Y的总能量一定小于生成物M和N的总能量 |
已知298 K,101 kPa时,2SO2(g)+O2(g)  2SO3(g);ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
2SO3(g);ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
| A.Q2<Q1<197 kJ·mol-1 | B.Q2=Q1=197 kJ·mol-1 |
| C.Q1<Q2<197 kJ·mol-1 | D.Q2=Q1<197 kJ·mol-1 |
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
| A.该反应为吸热反应 |
| B.A物质能量一定低于C物质能量 |
| C.该反应只有在加热条件下才能进行 |
| D.反应物的总能量高于生成物的总能量 |
(12分)(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
| 化学键 | H—H | O=O | H—O |
| 键能kJ/mol | 436 | 496 | 463 |
(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是 (填“Cu”或“Fe”); 若Zn、Ag和稀盐酸构成原电池,正极发生 反应(填“氧化”或“还原”),电解质溶液中阳离子移向 极(填“正”或“负”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)
 xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。 