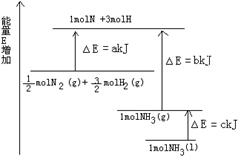
题目内容
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。
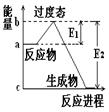
请认真观察下图,然后回答问题。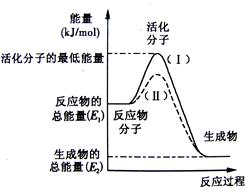
(1)图中所示反应是 (填“吸热”或“放热”)反应,引发该反应时 (填“需要”或“不需要”)加热,该反应的热效应的绝对值为
(用含E1、E2的代数式表示)。
(2)已知反应:H2(g)+1/2 O2(g)=H2O(g)的热效应为为241.8 kJ·mol-1,则其逆反应的活化能为_____kJ·mol-1。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是 。
(1)放热;需要,|E1-E2|;(2)409;(3)使用催化剂。
解析试题分析:(1)图中所示反应物能量关于生成物能量,故反应是放热反应,因为活化分子能量高于反应物,故引发该反应时需要加热,该反应的热效应的绝对值为|E1-E2|或|E2-E1|;
(2)已知反应:H2(g)+1/2 O2(g)=H2O(g)的热效应为为241.8 kJ·mol-1,则其逆反应H2O(g)=H2(g)+1/2 O2(g)的活化能为反应热的绝对值+正反应的活化能kJ·mol-1。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,加入了催化剂,活化能大大降低,活化分子百分数增多,反应速率加快。
考点:活化分子理论图像解说。

 阅读快车系列答案
阅读快车系列答案下列关于反应过程中能量变化的说法正确的是
| A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
| B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2 |
| C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |
已知298 K,101 kPa时,2SO2(g)+O2(g)  2SO3(g);ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
2SO3(g);ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
| A.Q2<Q1<197 kJ·mol-1 | B.Q2=Q1=197 kJ·mol-1 |
| C.Q1<Q2<197 kJ·mol-1 | D.Q2=Q1<197 kJ·mol-1 |
(12分)(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
| 化学键 | H—H | O=O | H—O |
| 键能kJ/mol | 436 | 496 | 463 |
(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是 (填“Cu”或“Fe”); 若Zn、Ag和稀盐酸构成原电池,正极发生 反应(填“氧化”或“还原”),电解质溶液中阳离子移向 极(填“正”或“负”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)
 xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。 (7分)在研究化学反应中的能量变化时,我们通常做下面的实验:
在一个小烧杯里,加入20 g已研磨成粉末的Ba(OH)2·8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据实验步骤,填写下表,并回答问题。
| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的___①__产生 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是_ ② 反应 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有_③___生成 |
① ② ③
(2)实验中要立即用玻璃棒迅速搅拌的原因是: __________________。(2分)
(3)在上述实验过程中,为什么用浸有稀硫酸的湿棉花置于多孔塑料板上?(2分)
___________________________________________________________。
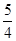 O2(g)=
O2(g)= P4O10(s);Δ H=-738.5KJ·mol-1
P4O10(s);Δ H=-738.5KJ·mol-1 说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。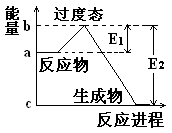
 CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.