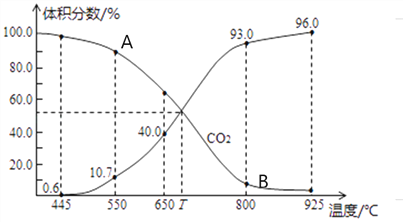
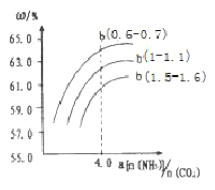
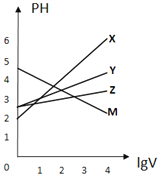
题目内容
【题目】工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解后,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.回答下列问题:
(1)为除去溶液中的Fe2+,可先加入______(填化学式)将Fe2+氧化为Fe3+,反应的离子方程式为__________,然后再加入适量的__________调整溶液的pH到______,使Fe3+转化为Fe(OH)3。
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3molL-1,则Cu(OH)2开始沉淀时溶液的pH为______,Fe3+完全沉淀时溶液的pH为______,通过计算确定上述方案______ (填“可行”或“不可行”)。
【答案】 H2O2 2Fe2++H2O2+2H+==2Fe3++2H2O CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3 3~4 4 3 可行
【解析】试题分析:本题以粗制CuO粉末制取纯净的胆矾晶体为载体,考查物质的分离提纯,溶度积的计算。
(1)由于pH![]() 9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH
9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH![]() 6.4时,Cu2+以Cu(OH)2的形式完全沉淀;除去溶液中的Fe2+,先加入氧化剂将Fe2+氧化,为了不引入杂质,加入的氧化剂选H2O2,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀,为了不引入杂质,然后加入适量的CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)调整溶液的pH至3~4,使Fe3+完全转化为Fe(OH)3沉淀。
6.4时,Cu2+以Cu(OH)2的形式完全沉淀;除去溶液中的Fe2+,先加入氧化剂将Fe2+氧化,为了不引入杂质,加入的氧化剂选H2O2,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀,为了不引入杂质,然后加入适量的CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)调整溶液的pH至3~4,使Fe3+完全转化为Fe(OH)3沉淀。
(2)常温下,Cu(OH)2开始沉淀时c(Cu2+)·c2(OH-)=Ksp[Cu(OH)2]=3![]() 10-20,c(OH-)=
10-20,c(OH-)=![]() =1
=1![]() 10-10mol/L,c(H+)=1
10-10mol/L,c(H+)=1![]() 10-4mol/L,Cu(OH)2开始沉淀时溶液的pH=4。Fe3+完全沉淀时c(Fe3+)
10-4mol/L,Cu(OH)2开始沉淀时溶液的pH=4。Fe3+完全沉淀时c(Fe3+)![]() 1
1![]() 10-5mol/L,c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3]=1
10-5mol/L,c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3]=1![]() 10-38,c(OH-)=
10-38,c(OH-)=![]() =1
=1![]() 10-11mol/L,c(H+)=1
10-11mol/L,c(H+)=1![]() 10-3mol/L,Fe3+完全沉淀时溶液的pH=3。根据计算结果知上述方案可行。
10-3mol/L,Fe3+完全沉淀时溶液的pH=3。根据计算结果知上述方案可行。

【题目】下列说法中正确的是
A.把煤粉碎了再燃烧可以提高煤的燃烧效率
B.增加炼铁高炉的高度可以降低尾气中CO的含量
C.无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率
D.用完的电池可以随意地丢弃
【题目】某学习小组对某葡萄酒中SO2的含量进行检测,按下图连接好仪器。回答下列问题:

Ⅰ.样品蒸馏
取20.00mL样品和250 mL水置于仪器A中,仪器B是去掉塞子的碘量瓶,向其中装人25mL 乙酸铅溶液,然后向仪器A中加入10 mL盐酸,立即盖塞蒸馏;当碘量瓶中的液体约200 mL时,将插入碘量瓶液面下的导管向上提起并将导管置于液面上方1cm 处,再蒸馏2min左右;最后用少量蒸馏水冲洗碘量瓶中的导管,并将冲洗液并入碘量瓶中。同时做空白实验(即不加样品情况下按同法操作,防止实验误差)。
已知:SO2+H2O+Pb(CH3COO)2=PbSO3↓+2CH3COOH。
(1)仪器A 的名称是_________________ 。
(2)实验中使用的碘量瓶最适宜的规格是_________ (填标号)。
a.100 mL b.250 mL c.500 mL d.1000 mL
(3)如果实验最后未用少量蒸馏水冲洗碘量瓶中的导管,会导致测定结果__________(填“偏高”“ 偏低”或“不影响”)。
Ⅱ.滴定操作
向取下的碘量瓶中加入10 mL盐酸和1mL淀粉溶液,摇匀后用0.01mol·L-1的碘标准溶液滴定,记录消耗的碘标准溶液的体积为V( 单位为mL)。
(4)滴定终点的现象是_____________________,该滴定反应的离子方程式是______________。
Ⅲ.结果分析
(5)甲组4 次实验测得V分别为
实验 | 1 | 2 | 3 | 4 |
V/mL | 9.98 | 12.00 | 10.02 | 10.00 |
据此可计算此葡萄酒中SO2的含量为_______mg·L-1
乙组认为甲组实验不严谨,可能会有误差,因为甲组未做_____________________。