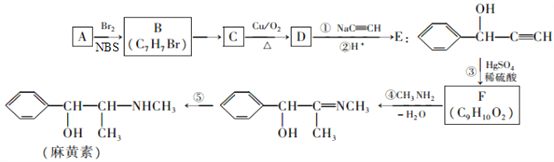
题目内容
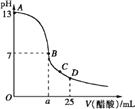
【题目】常温下,取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
A. 相同条件下,对于c(R-)/[c(HR)·c(OH-)]的值(R代表A或B),一定存在HA>HB
B. 常温下pH:NaA溶液>NaB溶液
C. X是HA,M是HB
D. 若常温下浓度均为0.1mol/L的NaA和HA的溶液等体积混合,则c(A-)+c(HA)=0.2mol/L
【答案】A
【解析】已知:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3,则酸性:H2CO3>HA>HCO3->HB,加水稀释,促进弱酸的电离,酸性越弱,溶液稀释时pH变化越小,所以加水稀释相同的倍数时,pH变化小的是HB,由图可知,Z为HB,Y为HA,A.0.1mol/L的NaA和NaB两种盐溶液各1L,水解程度A-<B-,B-离子减少的多,则![]() 一定存在HA>HB,选项A正确;B.酸性:H2CO3>HA>HCO3->HB,酸性越弱对应阴离子水解程度越大,减小越强,常温下pH:NaA溶液<NaB溶液,选项B错误;C.加水稀释相同的倍数时,酸溶液PH增大,pH变化小的是HB,Z为HB,选项C错误;D. 若常温下浓度均为0.1mol/L的NaA和HA的溶液等体积混合,根据物料守恒,则c(A-)+c(HA)=
一定存在HA>HB,选项A正确;B.酸性:H2CO3>HA>HCO3->HB,酸性越弱对应阴离子水解程度越大,减小越强,常温下pH:NaA溶液<NaB溶液,选项B错误;C.加水稀释相同的倍数时,酸溶液PH增大,pH变化小的是HB,Z为HB,选项C错误;D. 若常温下浓度均为0.1mol/L的NaA和HA的溶液等体积混合,根据物料守恒,则c(A-)+c(HA)=![]() =0.1mol/L,选项D错误。答案选A。
=0.1mol/L,选项D错误。答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】碳、氮及其化合物与生活密切相关。请根据要求回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= —574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= —1160kJ/mol
③H2O(g)=H2O(l) △H= —44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式_________。
(2)已知:反应I:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H<0
2N2(g)+6H2O(g) △H<0
①在恒温恒容装置中充入一定量的NH3和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是___(填字母序号)。
A.增大压强,Kp(用压强表示的化学平衡常数)增大
B.若测得容器内3v(NH3)=2v (H2O)时,说明反应已达平衡
C.通入一定量的氮气,则化学反应速率增大
D.达到平衡时体系的压强不再变化
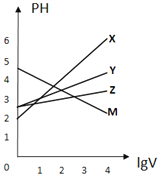
②氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,得有关物质的量关系如图,该催化剂在低温时选择反应_____(填“I”或“II”)。
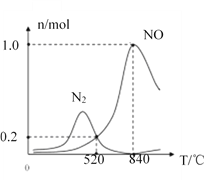
③520℃时,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式,无需化简)。恒压容器中,为了提高NH3转化为N2平衡转化率的措施有______(填字母序号)
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式,无需化简)。恒压容器中,为了提高NH3转化为N2平衡转化率的措施有______(填字母序号)
A.降低反应温度 B. 投料比不变,增加反应物的浓度
C.增大NH3和O2的初始投料比 D. 充入一定量的氦气
(3)己知25℃时HCN和H2CO3的电离常数(Ka.)如下表:
物质 | 电离常数(Ka) |
HCN | Ka=5×10-10 |
H2CO3 | Ka1=4.5×10-7;Ka2=4.7×10-11 |
25℃时,测得等体积等浓度的HCN和NaCN的混合溶液pH=11,则c(Na+)、c(H+)、c(CN—)、c(OH—)、c(HCN)浓度由大到小顺序为______,向NaCN溶液中通入少量CO2,则发生反应的化学方程式为:______________________。