题目内容
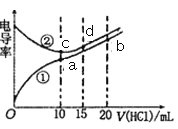
【题目】某学习小组对某葡萄酒中SO2的含量进行检测,按下图连接好仪器。回答下列问题:

Ⅰ.样品蒸馏
取20.00mL样品和250 mL水置于仪器A中,仪器B是去掉塞子的碘量瓶,向其中装人25mL 乙酸铅溶液,然后向仪器A中加入10 mL盐酸,立即盖塞蒸馏;当碘量瓶中的液体约200 mL时,将插入碘量瓶液面下的导管向上提起并将导管置于液面上方1cm 处,再蒸馏2min左右;最后用少量蒸馏水冲洗碘量瓶中的导管,并将冲洗液并入碘量瓶中。同时做空白实验(即不加样品情况下按同法操作,防止实验误差)。
已知:SO2+H2O+Pb(CH3COO)2=PbSO3↓+2CH3COOH。
(1)仪器A 的名称是_________________ 。
(2)实验中使用的碘量瓶最适宜的规格是_________ (填标号)。
a.100 mL b.250 mL c.500 mL d.1000 mL
(3)如果实验最后未用少量蒸馏水冲洗碘量瓶中的导管,会导致测定结果__________(填“偏高”“ 偏低”或“不影响”)。
Ⅱ.滴定操作
向取下的碘量瓶中加入10 mL盐酸和1mL淀粉溶液,摇匀后用0.01mol·L-1的碘标准溶液滴定,记录消耗的碘标准溶液的体积为V( 单位为mL)。
(4)滴定终点的现象是_____________________,该滴定反应的离子方程式是______________。
Ⅲ.结果分析
(5)甲组4 次实验测得V分别为
实验 | 1 | 2 | 3 | 4 |
V/mL | 9.98 | 12.00 | 10.02 | 10.00 |
据此可计算此葡萄酒中SO2的含量为_______mg·L-1
乙组认为甲组实验不严谨,可能会有误差,因为甲组未做_____________________。
【答案】 蒸馏烧瓶 c 偏低 滴加最后一滴碘标准溶液后。溶液颜色变蓝,且30s内不褪色 SO2+I2+2H2O=4H++SO42-+2I-(或H2SO4+I2+H2O=4H++SO42-+2I- ) 320 空白实验
【解析】(1)仪器A的名称是蒸馏烧瓶。
(2)由已知条件知A中加入物质的总体积为285ml,进行蒸馏,碘量瓶中的液体约200mL时,将插入碘量瓶液面下的导管向上提起并将导管置于液面上方1cm处,再蒸馏2min左右;最后用少量蒸馏水冲洗碘量瓶中,所以选择500 mL合适。答案:c。
(3)如果实验最后未用少量蒸馏水冲洗碘量瓶中的导管,会有一小部分物质停留在导管中,会导致测定结果偏低。答案:偏低。
(4)因为碘遇淀粉变蓝,开始发生. SO2+I2+2H2O=4H++SO42-+2I-,当SO2反应完全后,再滴溶液就会变蓝色,所以达到滴定终点的现象是滴加最后一滴碘标准溶液后。溶液颜色变蓝,且30s内不褪色,该滴定反应的离子方程式是SO2+I2+2H2O=4H++SO42-+2I-。
(5)有反应 SO2 + I2 + 2H2O=4H++SO42-+2I-
1mol 1mol
0.01 X (9.98+10.02+10.00)/3000![]() 0.01mol·L-1
0.01mol·L-1
X=10-2mol
葡萄酒中SO2的含量为=10-2mo![]() l
l![]() 64g/mol=320mg·L-1 答案:320。
64g/mol=320mg·L-1 答案:320。

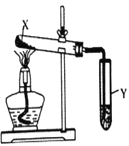
【题目】按图装置进行实验,下列现象能推断出结论的是( )
选项 | 试剂X | Y中试剂及现象 | 结论 | 装置 |
A | 一种盐 | 酚酞溶液未变红 | 该盐不可能是铵盐 |
|
B | 小苏打和纯碱 | 石灰水变浑浊 | 纯碱比小苏打稳定 | |
C | 氢氧化钙与氯化铵 | 硝酸银溶液中先产生沉淀后溶解 | Ag2O能溶于氨水 | |
D | 氯酸钾与二氧化锰 | 淀粉、碘化钾和和硫酸的混合溶液变蓝 | 反应产生了Cl2 |
A. A B. B C. C D. D